Het smeltpunt en het kookpunt vertegenwoordigen de temperatuur waarbij een stof bij een bepaalde druk van toestand verandert.
In het geval van het smeltpunt verandert de stof van de vaste toestand naar de vloeibare toestand. Het kookpunt verwijst naar de overgang van de vloeibare toestand naar de gasvormige toestand.
IJs begint bijvoorbeeld in vloeibare vorm in water te veranderen wanneer de temperatuur gelijk is aan 0°C. Het smeltpunt van water is dus 0 °C (onder een druk van 1 atmosfeer).
Om van vloeibaar naar stoom te gaan, moet water een temperatuur van 100°C bereiken. Het kookpunt van water is dus 100 °C (onder een druk van 1 atmosfeer).

Fusiepunt
Wanneer een stof in vaste toestand ontvangt warmte, is er een toename in de mate van agitatie van zijn moleculen. Daardoor stijgt ook de temperatuur.
Bij het bereiken van een bepaalde temperatuur (smeltpunt) is de agitatie van de moleculen zodanig dat ze de interne bindingen tussen atomen en moleculen verbreken.
Op dit punt begint de substantie van toestand te veranderen en zal in een vloeibare toestand overgaan als deze warmte blijft ontvangen.
Tijdens de Fusie de temperatuur blijft constant, omdat de ontvangen warmte alleen wordt gebruikt voor de verandering van toestand.

De warmte per massa-eenheid die nodig is om van fase te veranderen heet latente warmte van fusie (Lf) en is een kenmerk van de stof.
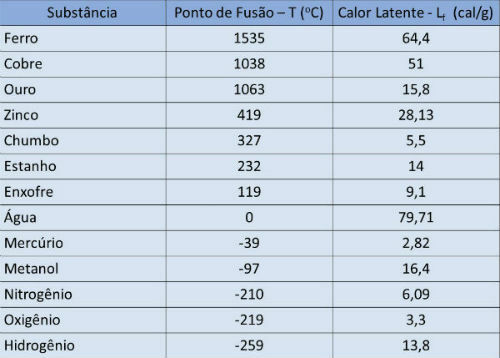
Smeltpunt en latente warmtetafel
In onderstaande tabel geven we de smeltpunttemperatuur en de latente warmte van sommige stoffen aan om luchtdruk.
Kookpunt
DE kokend het wordt gekenmerkt door de snelle overgang van een vloeibare naar een gasvormige toestand, met de vorming van dampen (bellen) in de vloeistof.
Net als bij fusie is er een temperatuur (kookpunt) waarbij een bepaalde stof overgaat van een vloeibare naar een gasvormige toestand.
Om dit te laten gebeuren, moet de stof warmte ontvangen. Tijdens de gehele faseovergang blijft de temperatuur constant.
de latente warmte van verdamping (Lv) is de hoeveelheid warmte per massa-eenheid die nodig is om een stof van fase te laten veranderen.
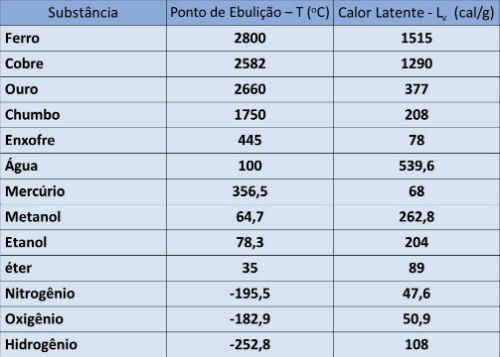
Kookpunt en latente warmtetabel
In onderstaande tabel geven we de kookpunttemperatuur en de latente verdampingswarmte van sommige stoffen bij atmosferische druk aan.
Drukinterferentie
De temperatuur van het smeltpunt en het kookpunt hangt af van de druk die op de stof wordt uitgeoefend.
Over het algemeen nemen stoffen in volume toe wanneer ze fusie ondergaan. Dit feit betekent dat hoe hoger de druk, hoe hoger de temperatuur voor de stof om van fase te veranderen.
De uitzondering doet zich voor bij sommige stoffen, waaronder water, waarvan het volume bij het smelten afneemt. In dit geval zal een hogere druk het smeltpunt verlagen.

Een drukverlaging zorgt ervoor dat het kookpunt van een bepaalde stof lager is, wat betekent dat de stof bij een lagere temperatuur gaat koken.
Op plaatsen boven zeeniveau kookt water bijvoorbeeld bij temperaturen onder 100°C. Hierdoor duurt het koken op deze plekken veel langer dan op plekken op zeeniveau.
Lees ook:
- Veranderingen in fysieke toestand
- Thermometrische schalen
- Thermometrische weegschalen - Oefeningen
- Fysische toestanden van water
- Fasen diagram
- stollen
- condensatie
- Colligatieve eigenschappen
- Periodieke eigenschappen
- Verdamping
- Oefeningen op het periodiek systeem