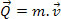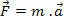De eerste wet van de thermodynamica gaat over wat er nodig is om werk in warmte te veranderen.
Het is gebaseerd op de principe van energiebesparing, wat een van de belangrijkste principes van de natuurkunde is.
Deze energiebesparing vindt plaats in de vorm van warmte en arbeid. Het maakt het voor een systeem mogelijk om energie te besparen en over te dragen, dat wil zeggen, energie kan toenemen, afnemen of constant blijven.
De eerste wet van de thermodynamica wordt uitgedrukt door de formule
Q = τ + ΔU
Waar,
Vraag: warmte
τ: werk
U: variatie van interne energie
De basis is dus: warmte (Q) is het resultaat van de som van arbeid (τ) met de variatie van interne energie (ΔU).
Het is ook als volgt te vinden:
ΔU = Q - W
Waar,
U: variatie van interne energie
Vraag: warmte
W: werk
De fundering resulteert in hetzelfde: de variatie van de interne energie (ΔU) is het resultaat van de warmte die wordt uitgewisseld met het externe medium minus de uitgevoerde arbeid (W).
Dat betekent,
1) wat betreft warmte (Q):
- Als de met het medium uitgewisselde warmte groter is dan 0, ontvangt het systeem warmte.
- Als de met het medium uitgewisselde warmte kleiner is dan 0, verliest het systeem warmte.
- Als er geen warmte-uitwisseling met het medium is, dat wil zeggen als deze gelijk is aan 0, ontvangt of verliest het systeem geen warmte.
2) met betrekking tot werk (τ):
- Als de arbeid groter is dan 0, wordt het volume van iets dat aan warmte is blootgesteld uitgezet.
- Als het werk kleiner is dan 0, wordt het volume van iets dat aan warmte is blootgesteld verminderd.
- Als er geen werk is, dat wil zeggen, als het gelijk is aan 0, is het volume van iets dat aan warmte wordt blootgesteld constant.
3) met betrekking tot de variatie van interne energie (ΔU):
- Als de interne energievariatie groter is dan 0, is er een temperatuurstijging.
- Als de interne energievariatie kleiner is dan 0, is er een temperatuurdaling.
- Als er geen verandering in interne energie is, dat wil zeggen, als deze gelijk is aan 0, is de temperatuur constant.
Er wordt geconcludeerd dat de temperatuur kan worden verhoogd met warmte of met arbeid.
Voorbeeld
De verwarming van gassen zorgt ervoor dat de machines opstarten, dat wil zeggen om bijvoorbeeld werkzaamheden in een fabriek uit te voeren.
Dit gebeurt op de volgende manier: de gassen dragen energie over in de machines, waardoor ze in volume toenemen en van daaruit de mechanismen van de machines activeren. Wanneer geactiveerd, beginnen de mechanismen te werken.
Lees ook
- Thermodynamica
- Carnot-cyclus
- Wet van Hess
Wetten van de thermodynamica
De wetten van de thermodynamica zijn vier. Naast de eerste, waar we mee te maken hebben, zijn er:
- Nulwet van de thermodynamica - behandelt de voorwaarden voor het verkrijgen van thermisch evenwicht;
- Tweede wet van de thermodynamica - behandelt de overdracht van thermische energie;
- Derde wet van de thermodynamica - behandelt het gedrag van materie met entropie dicht bij nul.
Opdrachten
1. (Ufla-MG) In een omkeerbare gasvormige transformatie is de variatie van de interne energie + 300 J. Er was compressie en de arbeid verricht door de druk van het gas is, in module, 200 J. Dus het is waar dat gas
a) gaf 500 J warmte aan het medium
b) gaf 100 J warmte aan het medium
c) kreeg 500 J warmte van het medium
d) kreeg 100 J warmte van het medium
e) onderging een adiabatische transformatie
Alternatief d: kreeg 100 J warmte uit het midden
Zie ook: Oefeningen over thermodynamica
2. (MACKENZIE-SP) Houd een nauwe opening in je mond, blaas nu krachtig in je hand! Het zag? Je hebt een adiabatische transformatie geproduceerd! Daarin onderging de lucht die je uitspuugde een gewelddadige expansie, waarbij:
a) het uitgevoerde werk kwam overeen met de afname van de interne energie van deze lucht, aangezien er geen warmte-uitwisseling was met de externe omgeving;
b) het uitgevoerde werk kwam overeen met de toename van de interne energie van deze lucht, aangezien er geen warmte-uitwisseling was met de externe omgeving;
c) het uitgevoerde werk kwam overeen met de toename van de hoeveelheid warmte die door deze lucht met het medium wordt uitgewisseld, aangezien er geen variatie was in zijn interne energie;
d) er werden geen werkzaamheden uitgevoerd, aangezien de lucht geen warmte uit de omgeving opnam en geen variatie in interne energie ondervond;
e) er werden geen werkzaamheden uitgevoerd, aangezien de lucht geen warmte aan het medium afstond en geen verandering in interne energie ondervond.
Alternatief a: de uitgevoerde werkzaamheden kwamen overeen met de vermindering van de interne energie van deze lucht, aangezien er geen warmte-uitwisseling met de externe omgeving is.
Zie ook: adiabatische transformatie