Alkenen of alkenen zijn koolwaterstoffen met een dubbele binding in hun koolstofketen.
De algemene formule voor alkenen is: CNeeH2n.
De meeste alkenen worden in het laboratorium geproduceerd en weinigen worden in de natuur aangetroffen.
Kenmerken
De belangrijkste kenmerken van alkenen zijn:
- kleurloos
- Onoplosbaar in water
- Oplosbaar in alcohol en ether
- Ze zijn reactiever dan alkanen
- Smelt- en kookpunten zijn hoger dan die van alkanen met hetzelfde aantal koolstofatomen
- Het eenvoudigste alkeen is ethyleen of ethyleen
Weet ook over:
- alkanen
- Alkynen
- alkadieen
Nomenclatuur
Alkenen krijgen dezelfde nomenclatuur als andere koolwaterstoffen.
PREFIX + INFIX + SUFFIX
Het voorvoegsel geeft de hoeveelheid koolstoffen in de hoofdketen aan.
Het tussenvoegsel wordt gegeven door de term "en", die de dubbele binding vertegenwoordigt. Het achtervoegsel wordt gegeven door de letter "o", die de koolwaterstofverbinding aangeeft.
Alkenen worden dus genoemd als achtervoegsel –eno, wat de dubbele binding aangeeft.
Daarnaast moet de positie van de dubbele binding worden aangegeven. Dit getal gaat vooraf aan de naam van het alkeen en geeft het koolstofatoom aan waar de binding begint.
De koolstofketen begint te worden genummerd vanaf het dichtstbijzijnde uiteinde van de dubbele binding.
Voorbeelden
Etheen of ethyleen: CH2 = CH2
Propyleen of Propeen: CH2 = CH - CH3, waarvan de equivalente formule als volgt is geschreven: CH3 — CH = CH2
1-buteen: CH2 = CH - CH2 – CH3
2-buteen: CH3 – CH = CH – CH3
Het is gebruikelijk dat alkenen ook aanwezig zijn isomerie:
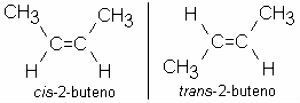
vertakte alkenen
Alkenen kunnen ook vertakt zijn. In dit geval is de hoofdketen de langste en heeft deze de dubbele binding.
Voorbeeld:
5-methyl-2-hexaan
Leer meer over Nomenclatuur van koolwaterstoffen.
Vul je onderzoek aan op Koolwaterstoffen. Lees ook:
- benzeen
- Butaan
- Cyclanen
- Aardolie
- Organische bestanddelen
- Aromatische koolwaterstoffen
- Oefeningen over koolwaterstoffen