De derde wet van de thermodynamica behandelt het gedrag van materie met een entropie die nul nadert.
Volgens deze wet, wanneer een systeem in thermodynamisch evenwicht is, nadert de entropie nul.
De tweede wet van de thermodynamica heeft betrekking op entropie. Vervolgens verschijnt de derde wet als a proberen een absoluut referentiepunt vast te stellen dat de entropie bepaalt.
Walther Nernst (1864-1941) was de natuurkundige die zich bezighield met de principes die de basis vormden voor de derde wet van de thermodynamica.
Volgens Nernst zou entropie de neiging hebben om een minimumwaarde te hebben als de temperatuur van een zuivere stof gelijk zou zijn aan of het absolute nulpunt zou benaderen.
Daarvoor stelde Nernst de onderstaande formule voor, die laat zien dat de variatie van entropie (ΔS) en temperatuur (T) neigen naar minimumwaarden, dat wil zeggen 0:
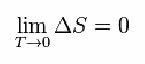
Maar wat is entropie?
Entropie het is de manier waarop moleculen zichzelf organiseren in het systeem. Deze organisatie vertaalt zich in wanorde, niet in de zin van verwarring, maar in de zin van beweging en agitatie van moleculen.
Hoe meer moleculen kunnen bewegen, hoe ongeorganiseerder ze zijn, hoe meer entropie ze hebben.
Aanvankelijk suggereerde Nernst dat de entropie die hij voorstelde alleen mogelijk zou zijn op perfecte kristallen.
Ten slotte concludeerde hij dat de temperatuur gelijk aan het absolute nulpunt niet bestond, wat de derde wet tot een controversiële wet maakt.
Voor veel natuurkundigen is dit dus geen wet maar een regel.
Na zoveel jaren (sinds 1912) proberen wetenschappers deze temperatuur of temperaturen te verkrijgen die steeds dichter bij het absolute nulpunt komen. Zo ontdekten ze dat het alleen mogelijk is in gassen, waarbij elke stof in vaste of vloeibare toestand wordt weggegooid.
Lees ook:
- Nulwet van de thermodynamica
- Eerste wet van de thermodynamica
- Tweede wet van de thermodynamica
- Oefeningen over thermodynamica