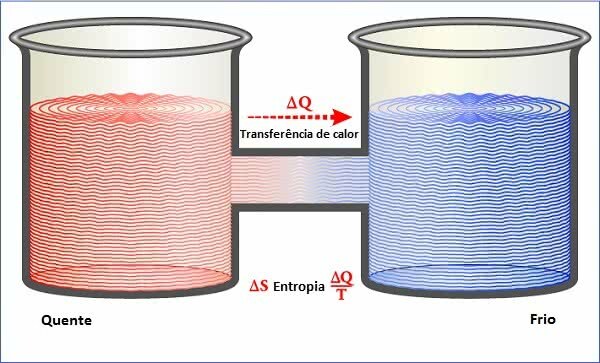
Veranderingen in de fysieke toestand zijn afhankelijk van enkele factoren die verband houden met temperatuur, druk en de hoeveelheid energie die bij het proces betrokken is.
In de natuur zijn er drie fysieke toestanden van materie: vast, vloeibaar en gas. En fysieke toestandsveranderingen vertegenwoordigen de vijf processen van verandering van de ene toestand naar de andere.
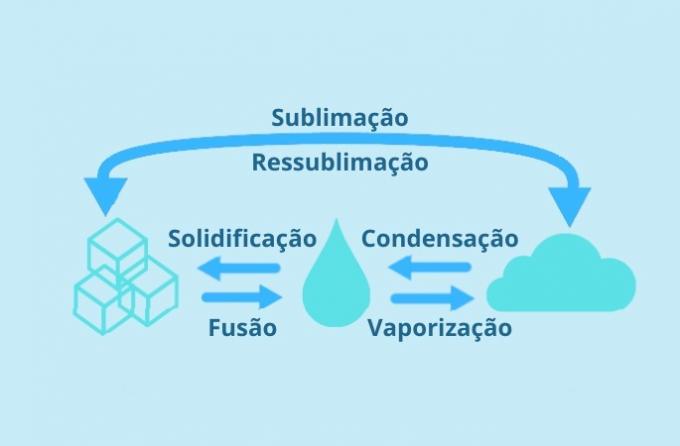
De veranderingen zijn: condensatie of liquefactie, stolling, fusie, verdamping en sublimatie. Elk type verandering heeft zijn specifieke kenmerken en is gerelateerd aan de kwaliteiten van de zaak.
condensatie
Condensatie vertegenwoordigt het verstrijken van de staat gasvormig naar vloeibaar.
Dit gebeurt door de afkoeling van een gas, dat de neiging heeft te condenseren en vloeibaar te worden.
stollen
Verharding is de passage van vloeibaar naar vaste toestand.
Een materie in vloeibare toestand heeft de neiging om vast te worden als het wordt afgekoeld. Bij water vindt stolling plaats bij 0 °C

Fusie
De fusie is de passage van de vaste toestand naar vloeistof.
De moleculen van elke stof hebben een bepaalde hoeveelheid energie nodig om te bewegen. Als er minder energie is, hebben ze de neiging om minder te bewegen en is het materiaal meestal vast.
Bij het ontvangen van energie van een warmtebron (verwarming), raken ze meer opgewonden en kunnen ze van toestand veranderen.

Verdamping
Verdamping is de passage van vloeibare naar gasvormige toestand. Dit kan op twee manieren gebeuren:
- kokend: snelle opwarming.
- Verdamping: langzame verwarming.
Van 1 °C tot 100 °C is het vloeibaar.

sublimatie
Sublimatie is de passage van vaste toestand naar gasvormig Het is van gasvormige toestand naar vaste stof (resublimatie).
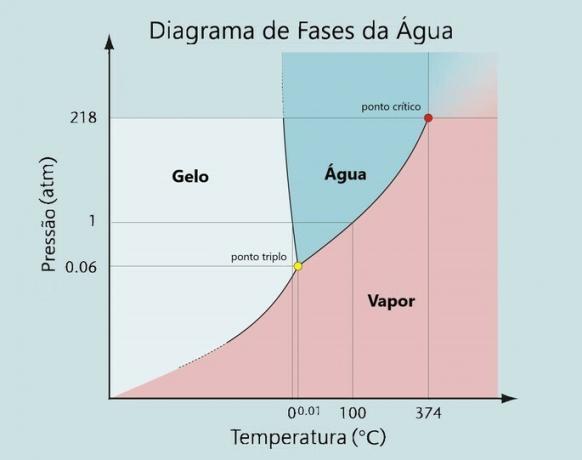
Dit type verandering vindt plaats afhankelijk van bepaalde druk- en temperatuuromstandigheden. Elk element heeft zijn Fasen diagram, waar de fusie-, verdampings- en sublimatiecurven zich bevinden.

Fysische toestanden van water
Water is gemakkelijk te vinden in zijn drie fysieke toestanden: vast, vloeibaar en gas.
Elke fysieke toestand van water is mogelijk volgens variaties in temperatuur en druk.
Bij normale druk (1atm) smelt water bij 0 °C en kookt het bij 100 °C.
Watermoleculen van -1 °C zijn in vaste toestand en bij 0 °C vindt de verandering (smeltpunt) van ijs van 0 °C naar water van 0 °C plaats.
Wanneer het een temperatuur van 100 °C bereikt, ondergaat het een nieuwe toestandsverandering (verdamping), gaande van een vloeibare naar een gasvormige toestand.
Zoals blijkt uit het fasediagram:
Lees voor meer informatie over dit onderwerp ook:
- Fysische toestanden van water
- Fysieke toestanden van materie
- Fysische en chemische transformaties
- Fysische en chemische verschijnselen