omschrijft zichzelf als hybridisatie de vereniging van onvolledige atomaire orbitalen. Een orbitaal wordt als onvolledig geclassificeerd als het er maar één heeft elektron erin in plaats van twee. Zie een weergave van een onvolledige orbitaal en een volledige orbitaal:

In afbeelding A hebben we een complete orbitaal; in afbeelding B, een onvolledige orbitaal.
Hybridisatie is een natuurlijk fenomeen dat optreedt bij sommige chemische elementen, zoals fosfor, zwavel, koolstof, enz. De hybridisatie van koolstof stelt de atomen van dit element in staat om vier chemische bindingen te maken, dat wil zeggen, koolstof maakt slechts vier bindingen na het fenomeen van hybridisatie te hebben ondergaan.
Maar waarom hybridiseert koolstof en maakt het vier bindingen? Om dit fenomeen te begrijpen, moeten we de elektronische distributie van dit element kennen:
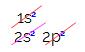
In de elektronische distributie van koolstof zien we dat het 1s-subniveau compleet is (met twee elektronen), de 2s is compleet (met twee elektronen) en het 2p-subniveau is onvolledig (het p-subniveau ondersteunt zes elektronen, maar er is slechts twee). Als we de 2p-elektronen op een representatieve manier verdelen, moeten we:
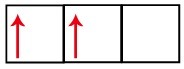
Het p-subniveau heeft drie orbitalen - in het geval van koolstof zijn er twee onvolledig en één leeg. Om deze reden zou dit element slechts twee koppelingen moeten uitvoeren, omdat het aantal onvolledige orbitalen altijd het aantal koppelingen bepaalt.
Bij het ontvangen van energie van de externe omgeving worden de elektronen in de koolstof echter geëxciteerd. Dus een van de elektronen die aanwezig zijn in subniveau 2s beweegt naar de orbitaal van subniveau p die leeg was:
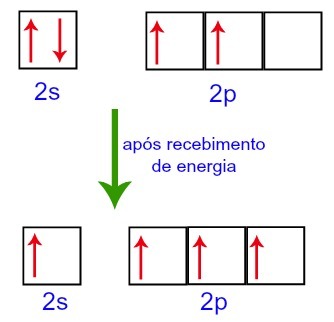
Koolstoforbitalen voor en na het ontvangen van energie uit de externe omgeving
Zo blijft koolstof achter met vier onvolledige orbitalen op het tweede niveau. Vervolgens voegt de orbitaal van het 2s-subniveau zich bij de drie p-orbitalen, wat het fenomeen van configureert hybridisatie.
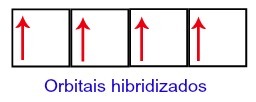
Koolstoforbitalen na hybridisatie
Door mij Diogo Lopes Dias
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/hibridizacao-carbono.htm

