Eiwitstructuur verwijst naar de natuurlijke conformatie die nodig is om zijn biologische functies uit te voeren.
Eiwitten zijn macromoleculen gevormd door de vereniging van aminozuren.
Aminozuren zijn met elkaar verbonden door peptidebindingen. Moleculen die ontstaan door het samenvoegen van aminozuren worden peptiden genoemd.
Eiwitten hebben vier structurele niveaus: primaire, secundaire, tertiaire en quaternaire structuur.
Primaire structuur van eiwitten
De primaire structuur komt overeen met: lineaire aminozuursequentie verbonden door peptidebindingen.
In sommige eiwitten kan het vervangen van het ene aminozuur door het andere leiden tot ziekte en zelfs de dood.
Ruimtelijke structuren van eiwitten
De ruimtelijke structuren van eiwitten zijn het resultaat van het vouwen en vouwen van de eiwitstreng op zichzelf.
De functionele eigenschappen van eiwitten zijn afhankelijk van hun ruimtelijke structuur.
Secundaire structuur
De secundaire structuur komt overeen met het eerste niveau van spiraalvormige wikkeling.
Het wordt gekenmerkt door regelmatige en zich herhalende patronen die lokaal voorkomen, veroorzaakt door de aantrekking tussen bepaalde nabijgelegen aminozuuratomen.
De twee meest voorkomende lokale arrangementen die overeenkomen met de secundaire structuur zijn alfa-helix en beta-blad of beta-geplooid.
- alfa helix conformatie: gekenmerkt door een driedimensionale opstelling waarin de polypeptideketen een spiraalvormige conformatie rond een denkbeeldige as aanneemt.
- beta-sheet conformatie: treedt op wanneer de polypeptideketen zich zigzag uitstrekt en naast elkaar kan worden gerangschikt.
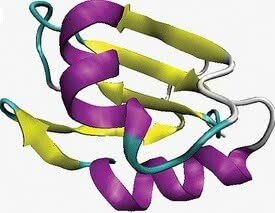
Secundaire structuur. In paars de alfa-helix conformatie en in geel het beta-blad
Tertiaire structuur
De tertiaire structuur komt overeen met de vouwing van de polypeptideketen op zichzelf.
In tertiaire structuur neemt het eiwit een specifieke driedimensionale vorm aan vanwege de globale vouwing van de gehele polypeptideketen.
Quaternaire structuur
Terwijl veel eiwitten worden gevormd door een enkele polypeptideketen. Anderen zijn opgebouwd uit meer dan één polypeptideketen.
De quaternaire structuur komt overeen met twee of meer polypeptideketens, identiek of niet, die groep en passen bij elkaar om de totale structuur van het eiwit te vormen.
Het insulinemolecuul bestaat bijvoorbeeld uit twee onderling verbonden ketens. Ondertussen bestaat hemoglobine uit vier polypeptideketens.
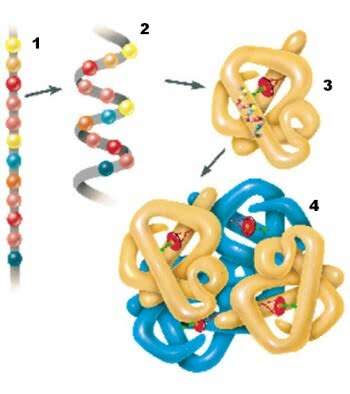
1. Primaire structuur; 2. Secundaire structuur; 3. Tertiaire structuur; 4. Quaternaire structuur.
Leer meer over Eiwitten.
Eiwitdenaturatie
Om hun biologische functies uit te voeren, moeten eiwitten hun natuurlijke conformatie presenteren.
Warmte, zuurgraad, zoutconcentratie en andere omgevingscondities kunnen de ruimtelijke structuur van eiwitten veranderen. Als gevolg hiervan ontspannen hun polypeptideketens zich en verliezen ze hun natuurlijke conformatie.
Wanneer dit gebeurt, noemen we het eiwit denaturatie.
Het resultaat van denaturatie is het verlies van de biologische functie die kenmerkend is voor dat eiwit.
De aminozuursequentie wordt echter niet gewijzigd. Denaturatie komt alleen overeen met het verlies van ruimtelijke conformatie van eiwitten.
Lees voor meer informatie ook over peptiden en peptidebindingen.



