Grafeen is een nanomateriaal dat alleen uit koolstof bestaat, waarin atomen met elkaar verbonden zijn en hexagonale structuren vormen.
Het is het fijnste kristal dat bekend is en zijn eigenschappen maken het zeer wenselijk. Dit materiaal is licht, elektrisch geleidend, stijf en waterdicht.
De toepasbaarheid van grafeen is op meerdere gebieden. De bekendste zijn: civiele bouw, energie, telecommunicatie, geneeskunde en elektronica.
Sinds de ontdekking is grafeen het onderzoekscentrum gebleven. De studie van toepassingen voor dit materiaal mobiliseert instellingen en investeringen van miljoenen euro's. Dus wetenschappers over de hele wereld blijven proberen een goedkopere manier te ontwikkelen om het op grote schaal te produceren.
Begrijpen wat grafeen is
Grafeen is een allotrope vorm van koolstof, waarbij de rangschikking van de atomen van dit element een dunne laag vormt.
Deze allotroop is tweedimensionaal, dat wil zeggen dat hij slechts twee afmetingen heeft: breedte en hoogte.
Om een idee te krijgen van de grootte van dit materiaal, komt de dikte van een vel papier overeen met de superpositie van 3 miljoen lagen grafeen.
Hoewel het het dunste materiaal is dat door de mens is geïsoleerd en geïdentificeerd, ligt de afmeting in de orde van nanometers. Het is licht en sterk en kan elektriciteit beter geleiden dan metalen zoals koper en silicium.
De rangschikking die de koolstofatomen in de structuur van grafeen aannemen, maakt dat er zeer interessante en wenselijke eigenschappen in terug te vinden zijn.
Grafeen toepassingen
Veel bedrijven en onderzoeksgroepen over de hele wereld publiceren resultaten van werk met toepassingen voor grafeen. Zie hieronder de belangrijkste.
| Drinkbaar water | Door grafeen gevormde membranen zijn in staat om zeewater te ontzilten en te zuiveren. |
|---|---|
| CO-uitstoot2 | Grafeenfilters kunnen de CO-uitstoot verminderen2 door het scheiden van gassen die worden gegenereerd door industrieën en bedrijven die zullen worden afgekeurd. |
| ziekte detectie | Veel snellere biomedische sensoren zijn gebaseerd op grafeen en kunnen ziekten, virussen en andere toxines detecteren. |
| Bouw | Door de toevoeging van grafeen worden bouwmaterialen als beton en aluminium lichter en sterker gemaakt. |
| Schoonheid | Haarkleuring door grafeen te spuiten, waarvan de duur ongeveer 30 wasbeurten zou zijn. |
| Micro-apparaten | Chips nog kleiner en sterker door vervanging van silicium door grafeen. |
| Energie | Zonnecellen hebben een betere flexibiliteit, meer transparantie en lagere productiekosten door het gebruik van grafeen. |
| Elektronica | Batterijen met een betere en snellere energieopslag kunnen in maximaal 15 minuten worden opgeladen. |
| Mobiliteit | Fietsen kunnen stevigere banden en frames hebben met een gewicht van 350 gram met grafeen. |
Grafeen structuur
De structuur van grafeen bestaat uit een netwerk van koolstoffen die in zeshoeken zijn verbonden.
De koolstofkern bestaat uit 6 protonen en 6 neutronen. De 6 elektronen van het atoom zijn verdeeld in twee lagen.
Bij valentie laag er zijn 4 elektronen, en deze schil kan er maximaal 8 bevatten. Daarom moet koolstof, om stabiliteit te verkrijgen, 4 verbindingen maken en de elektronische configuratie van een edelgas bereiken, zoals vermeld in de octetregel.
De atomen in grafeen binden door covalente bindingen, dat wil zeggen, er is het delen van elektronen.

Koolstof-koolstofbindingen zijn de sterkste bindingen die in de natuur worden gevonden en elke koolstof verbindt de andere 3 in de structuur. Daarom is de hybridisatie van het atoom sp2, wat overeenkomt met 2 enkele en één dubbele binding.
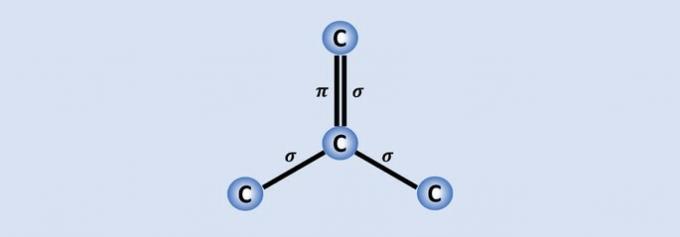
Van de 4 koolstofelektronen worden er drie gedeeld met de naburige atomen en één, die de binding vormt. , helpt grafeen bijvoorbeeld om een goede geleider van elektriciteit te zijn omdat het meer "vrijheid" in het materiaal heeft.
Grafeen eigenschappen

| Licht | Een vierkante meter weegt slechts 0,77 milligram. Een grafeen aerogel is ongeveer 12 keer lichter dan lucht. |
|---|---|
| Flexibel | Het kan tot 25% van zijn lengte uitzetten. |
| Geleider | Zijn huidige dichtheid hoger dan koper. |
| Duurzaam | Het zet uit bij kou en krimpt bij warmte. De meeste stoffen werken averechts. |
| Waterbestendig | Het door koolstof gevormde gaas laat zelfs geen heliumatoom door. |
| Resistent | Ongeveer 200 keer sterker dan staal. |
| Doorzichtig | Absorbeert slechts 2,3% van het licht. |
| Dun | Een miljoen keer dunner dan een mensenhaar. De dikte is slechts één atoom. |
| Moeilijk | Hardste materiaal dat bekend is, zelfs meer dan diamant. |
Geschiedenis en ontdekking van grafeen
De term grafeen werd voor het eerst gebruikt in 1987, maar werd pas in 1994 officieel erkend door de União de Química Pure and Applied.
Deze aanduiding is ontstaan uit de kruising van grafiet met het achtervoegsel -een, verwijzend naar de dubbele binding van de stof.
Sinds de jaren vijftig sprak Linus Pauling in zijn lessen over het bestaan van een dunne laag koolstof, opgebouwd uit zeshoekige ringen. Philip Russell Wallace beschreef jaren eerder ook enkele belangrijke eigenschappen van deze structuur.
Maar pas onlangs, in 2004, werd grafeen geïsoleerd door natuurkundigen Andre Geim en Konstantin Novoselov aan de Universiteit van Manchester en kan het diep bekend zijn.
Ze bestudeerden grafiet en slaagden erin met behulp van de techniek van mechanische exfoliatie een laag materiaal te isoleren met plakband. Deze prestatie leverde het paar in 2010 de Nobelprijs op.
Belang van grafeen voor Brazilië
Brazilië heeft een van de grootste reserves aan natuurlijk grafiet, een materiaal dat grafeen bevat. Grafiet natuurreservaten bereiken 45% van het wereldtotaal.
Hoewel het voorkomen van grafiet op het hele Braziliaanse grondgebied wordt waargenomen, zijn de geëxploiteerde reserves te vinden in Minas Gerais, Ceará en Bahia.
Met overvloedige grondstoffen investeert Brazilië ook in onderzoek in het gebied. Het eerste laboratorium in Latijns-Amerika dat zich toelegt op onderzoek met grafeen bevindt zich in Brazilië, aan de Universidade Presbiteriana Mackenzie in São Paulo, genaamd MackGraphe.
productie van grafeen
Grafeen kan worden bereid uit carbide, koolwaterstof, koolstofnanobuisjes en grafiet. De laatste wordt het meest gebruikt als uitgangsmateriaal.
De belangrijkste productiemethoden van grafeen zijn:
- Mechanische micro-exfoliatie: Een grafietkristal heeft laagjes grafeen die met een tape zijn afgestript, die worden afgezet op substraten die siliciumoxide bevatten.
- Chemische micro-exfoliatie: koolstofbindingen worden verzwakt door de toevoeging van reagentia, waardoor het netwerk gedeeltelijk wordt verbroken.
- chemische dampafzetting: vorming van grafeenlagen afgezet op vaste dragers, zoals metallisch nikkeloppervlak.
Grafeen prijs
De moeilijkheid om grafeen op industriële schaal te synthetiseren, betekent dat de waarde van dit materiaal nog steeds erg hoog is.
In vergelijking met grafiet is de prijs duizenden keren hoger. Terwijl 1 kg grafiet wordt verkocht voor 1 dollar, wordt de verkoop van 150 g grafeen gedaan voor 15.000 dollar.
Curiositeiten over grafeen
- Project van de Europese Unie, genaamd Grafeen vlaggenschip, trok zo'n 1,3 miljard euro uit voor onderzoek op het gebied van grafeen, toepassingen en ontwikkeling van productie op industriële schaal. Ongeveer 150 instellingen in 23 landen nemen deel aan dit project.
- De eerste koffer die is ontwikkeld voor ruimtereizen heeft grafeen in zijn samenstelling. De lancering is gepland voor 2033, wanneer NASA van plan is expedities naar Mars uit te voeren.
- Borofeen is de nieuwe concurrent van grafeen. Dit materiaal werd in 2015 ontdekt en wordt beschouwd als een verbeterde versie van grafeen, omdat het nog flexibeler, resistenter en geleidend is.
Grafeen in Enem
In de Enem 2018-test, een van de vragen van: Natuurwetenschappen en haar technologieën ging over grafeen. Bekijk hieronder de becommentarieerde oplossing van dit probleem.
Grafeen is een allotrope vorm van koolstof die bestaat uit een vlakke plaat (tweedimensionale reeks) van samengeperste koolstofatomen die slechts één atoom dik zijn. De structuur is zeshoekig, zoals weergegeven in de afbeelding.
In deze opstelling hebben de koolstofatomen hybridisatie
a) sp van lineaire geometrie.
b) sp2 van vlakke trigonale meetkunde.
c) sp3 afgewisseld met sp-gehybridiseerde koolstoffen van lineaire geometrie.
d) sp3d van vlakke geometrie.
e) sp3d2 met hexagonale vlakke geometrie.
juiste alternatief:b) sp2 van vlakke trigonale meetkunde.
Koolstofallotropie treedt op vanwege het vermogen om verschillende eenvoudige stoffen te vormen.
Omdat het 4 elektronen in de valentieschil heeft, is koolstof vierwaardig, dat wil zeggen dat het de neiging heeft om 4 covalente bindingen te maken. Deze bindingen kunnen enkelvoudig, dubbel of drievoudig zijn.
Afhankelijk van de bindingen die koolstof maakt, verandert de ruimtelijke structuur van het molecuul in de rangschikking die de atomen het beste herbergt.
Hybridisatie vindt plaats wanneer er een combinatie van orbitalen is, en voor koolstof kan dit zijn: sp, sp2 en sp3, afhankelijk van het type oproepen.
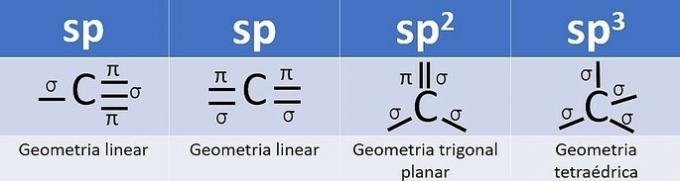
Het aantal hybride orbitalen is de som van de sigma (σ) bindingen die de koolstof maakt, aangezien de binding niet hybridiseert.
- sp: 2 sigma-links
- sp2: 3 sigma-links
- sp3: 4 sigma-links
De weergave van de grafeenallotroop in ballen en stokken, zoals weergegeven in de afbeelding in de vraag, toont niet de ware bindingen van de stof aan.
Maar als we naar een deel van de afbeelding kijken, zien we dat er één koolstofatoom is, dat een bal voorstelt, verbonden met drie andere koolstoffen die een structuur vormen als een driehoek.
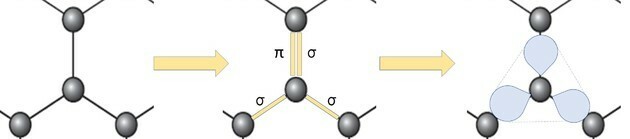
Als koolstof 4 bindingen nodig heeft en gebonden is aan 3 andere koolstoffen, dan is een van die bindingen dubbel.
Omdat het één dubbele en twee enkele bindingen heeft, heeft grafeen sp-hybridisatie2 en bijgevolg trigonale vlakke geometrie.
De andere bekende allotrope vormen van koolstof zijn: grafiet, diamant, fullereen en nanobuis. Hoewel ze allemaal van koolstof zijn gemaakt, hebben allotropen verschillende eigenschappen, die voortkomen uit hun verschillende structuren.
Lees ook: Chemie in Enem en Scheikundevragen in Enem.