O atoomstraal van elementen is een periodieke eigenschap die de straal van een atoom bepaalt, die varieert afhankelijk van de positie van het element in het periodiek systeem.
Ze kunnen dus toenemen en afnemen naarmate de atoomnummer (Z) van het element dat overeenkomt met het aantal protonen dat aanwezig is in de atoomkern.
Samenvattend komt de atoomstraal overeen met de helft van de afstand tussen de kernen van twee naburige atomen, uitgedrukt als volgt:
r = d/2
vanwaar:
r = straal
d = internucleaire afstand
Over het algemeen wordt de atomaire straal gemeten in picometers (pm), sub-veelvoud van de meter (1 picometer = 10-12 m.). Merk op dat wanneer de referentie geen atoom is maar een ion, de gevonden straal de ionische straal is.
Atomic Radius Variatie
In het periodiek systeem is de groei van de atomaire straal te zien in de volgende afbeelding:
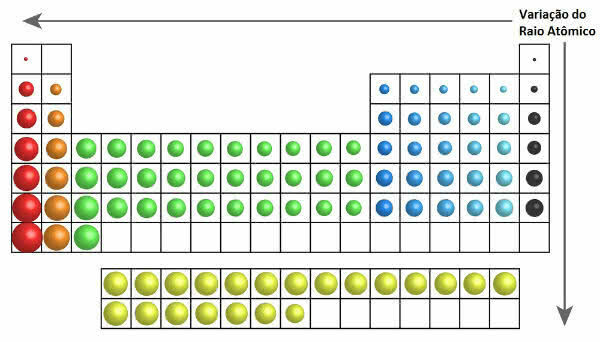 Atoomstraalvariatie in het periodiek systeem
Atoomstraalvariatie in het periodiek systeem
Dus verticaal (families of groepen) neemt de atoomstraal van boven naar beneden toe. Op de horizontale (perioden) nemen ze van rechts naar links toe.
Zie de inverse variatie in Elektronische affiniteit en elektronegativiteit.
Ionisatieenergie
DE ionisatie-energie (of potentieel) het is ook een periodieke eigenschap die de energie bepaalt die nodig is om een elektron te verschuiven, uitgedrukt in elektronvolt (eV).
Lees ook: Periodieke eigenschappen.
Controleer toelatingsexamenvragen met een becommentarieerde resolutie in: Oefeningen op het periodiek systeem.