Adsorptie is een fysisch-chemische eigenschap van moleculen van vloeibare, gasvormige en vaste stoffen.
Het proces vindt plaats wanneer vloeibare of gasvormige deeltjes op het oppervlak van vaste stoffen worden gevangen. Als de vaste stoffen poreus zijn, neemt de adsorptiecapaciteit nog meer toe.
Er zijn twee classificaties voor de componenten die deelnemen aan het proces:
- Adsorbaten: Het is de vloeibare of gasvormige stof die wordt vastgehouden op het oppervlak van een adsorberende vaste stof.
- Adsorbentia: Het is de vaste stof die het vasthouden van andere stoffen bevordert.
DE desorptie het is het omgekeerde proces van adsorptie, dat wil zeggen, het is de afgifte van adsorbaat van het oppervlak van het adsorbens.
Types
Afhankelijk van de aard van de krachten die bij het proces betrokken zijn, kan adsorptie van twee soorten zijn: fysisorptie en chemisorptie.
In sommige gevallen kunnen beide soorten adsorptie in hetzelfde proces voorkomen.
fysisorptie
De fysieke fysisorptie of adsorptie tussen het adsorbaat en het adsorbens vindt plaats door Van der Waalls-krachten (dipool-dipool of geïnduceerde dipool).
In dit geval is er geen type moleculaire verandering in de stoffen die bij het proces betrokken zijn. Dat wil zeggen, de stof behoudt zijn chemische aard.
Fysische adsorptie is een omkeerbaar proces.
Chemisorptie
Chemisorptie of chemische adsorptie bestaat uit a chemische reactie. Door het betrekken van elektronen, wordt beschouwd als een sterkere chemische binding dan fysisorptie.
Bij chemisorptie is er een moleculaire verandering van de stoffen die bij het proces betrokken zijn. Dat wil zeggen, de stof kan in een andere worden omgezet.
Aangezien dit een chemische reactie is, moeten de componenten van het adsorbens en het adsorbaat specificiteit hebben. Ze moeten kunnen herkennen en reageren.
Chemische adsorptie is een onomkeerbaar proces.
Lees ook over:
- Intermoleculaire krachten
- Chemische bindingen
Adsorptie en absorptie
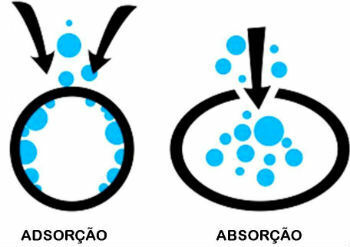
Verschil tussen adsorptie en absorptie
Adsorptie en absorptie zijn twee verschillende processen. Ken het verschil tussen hen:
- adsorptie: Een stof wordt echter vastgehouden op het oppervlak van een andere zonder deel uit te maken van zijn volume.
- Absorptie: De ene stof wordt door de andere opgenomen, waardoor het volume verandert.
Een bekend voorbeeld van absorptie is de spons die water absorbeert. Hierdoor wordt het volume water opgenomen in het volume van de spons.
Actieve kool
Actieve kool is een voorbeeld van een beter bekende adsorberende stof. In zijn structuur zijn er talrijke poriën die de retentie van stoffen intensiveren en hun adsorptiecapaciteit vergroten.
Daarom wordt actieve kool gebruikt om organische stoffen, oliën, kleuren en geuren te verwijderen. Het wordt ook gebruikt voor waterbehandeling en de vervaardiging van cosmetica en medicijnen.

Actieve kool
Lees ook:
- chromatografie
- Scheiding van mengsels
- Opgeloste en oplosmiddel
- Materialen die worden gebruikt in het laboratorium voor chemie