Sommige verbindingen hebben in hun structuur dubbele bindingen afgewisseld met enkele bindingen. De bekendste van allemaal is benzeen, waarvan de structuur in 1865 werd voorgesteld door de Duitse chemicus Friedrich August Kekulé (1829-1896). De structuur zou cyclisch zijn en gevormd worden door drie dubbele bindingen afgewisseld met drie enkele bindingen, zoals weergegeven in de onderstaande afbeeldingen:
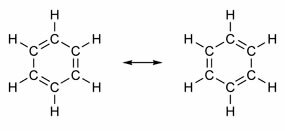
Beide manieren om benzeen weer te geven zijn acceptabel, omdat het mogelijk is om de elektronen in de π-bindingen te veranderen zonder de positie van de atomen te veranderen. Noch vertegenwoordigt echter precies wat hij is, noch verklaart zijn gedrag. Het zou zich als een alkeen moeten gedragen en additiereacties uitlokken, maar in de praktijk gebeurt dit niet. Benzeen is vrij stabiel en doet alsof het geen dubbele bindingen heeft; het geeft substitutiereacties zoals in alkanen.
In 1930 stelde de Amerikaanse wetenschapper Linus Pauling de resonantietheorie voor die deze schijnbare tegenstelling verklaarde. Deze theorie zei:
“Wanneer we in een structuurformule de positie van de elektronen kunnen veranderen zonder de positie van de atomen te veranderen, de echte structuur Nee zal geen van de verkregen structuren zijn, maar eerder a resonantie hybride van die structuren.”
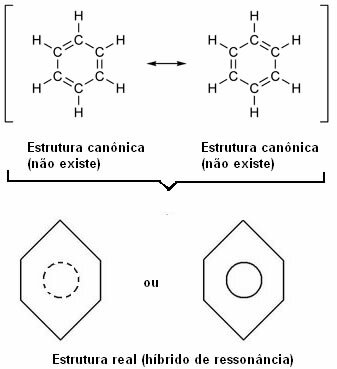
Dit effect wordt bewezen door de grootte van de koolstofbindingen en de afstand daartussen. Deze afstand ligt tussen die van de enkele binding (1,54 ) en die van de dubbele binding (1,34 ); zijnde daarom 1,39 Å, vanwege het resonantie-effect.
Dit effect is ook te zien in de structuur van het ozonmolecuul (O3), zoals hieronder weergegeven:
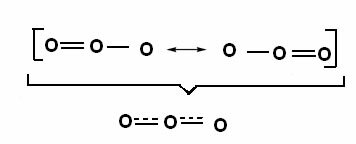
Canonische structuren en ozonresonantiehybriden.
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Brazilië Schoolteam.
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/ressonancia-compostosquimicos.htm
