Een neutraliserende reactie treedt op wanneer een zuur reageert met een base om water en zout te vormen. Het zuur levert de H-ionen+ en de base levert de OH-ionen- voor de vorming van water (H2O):
1 uur+(hier) + 1 OH-(hier) → H2O(ℓ)
Dit type reactie wordt "neutralisatie" genoemd omdat de pH van het medium wordt geneutraliseerd; de pH van water is 7,0 (neutraal).
Om deze reacties te laten plaatsvinden, is het nodig om een bepaalde hoeveelheid warmte af te geven, aangezien slechts een deel van de energie van de ionen worden gebruikt om de bindingen te vormen die resulteren in watermoleculen, terwijl de rest van de energie wordt vrijgegeven aan de heel. Deze vrijgekomen energie heet Neutralisatie Enthalpie (∆Hneutralisatie).

Omdat het warmte afgeeft, komt het overeen met exotherme reacties, waarbij de enthalpie (globale energie van het systeem) altijd negatief zal zijn, kleiner dan nul.
Bij een reactie tussen sterke zuren en sterke basen zal de neutraliserende enthalpiewaarde altijd gelijk zijn aan – 13,8 kcal/mol of – 57,7 kJ/mol. Dit komt omdat de basen en sterke zuren volledig in oplossing zijn gedissocieerd en daarom de enige De reactie die verantwoordelijk is voor de manifestatie van warmte is de vorming van water, zoals weergegeven in de drie onderstaande voorbeelden:
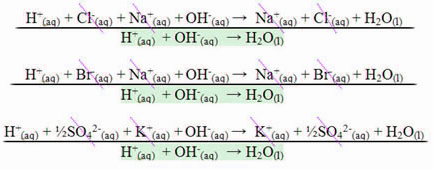
Bij neutralisatiereacties met zwakke zuren of basen zal de neutraliserende enthalpiewaarde lager zijn dan –57,7 kJ/mol.
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/entalpia-neutralizacao.htm

