Covalente binding is een soort interactie tussen atomen met een hoge elektronegativiteit, dat wil zeggen, hoge neiging om elektronen te ontvangen. De chemische elementen die gewoonlijk bij dit type binding betrokken zijn, zijn:
Waterstof (H)
Beryllium (Be)
Borium (B)
Koolstof (C)
Stikstof (N)
Fosfor (P)
Zuurstof (O)
Zwavel (S)
Fluor (F)
Chloor (Cl)
Broom (Br)
Jodium (ik)
a) Aard van de betrokken elementen
De chemische elementen die een hoge elektronegativiteit hebben en bijgevolg covalente bindingen uitvoeren zijn:
Waterstof
Ametalen
b) Optreden van covalente binding
Afhankelijk van de aard van de chemische elementen die betrokken zijn bij de covalente binding, kan dit als volgt gebeuren:
Tussen twee waterstofatomen;
Tussen een niet-metaalatoom en waterstof;
Tussen atomen van hetzelfde chemische element (niet-metaal);
Tussen atomen van verschillende chemische elementen (beide niet-metalen).
c) Aantal elektronen dat elk atoom moet ontvangen
Het aantal elektronen dat elk niet-metaal- of waterstofatoom in een binding ontvangt, is gerelateerd aan de octetregel.
Volgens de octetregel is een atoom stabiel wanneer het acht of twee elektronen verwerft (alleen in het geval van waterstof) in de valentieschil. Als een atoom bijvoorbeeld vijf elektronen in zijn valentieschil heeft, moet het drie elektronen ontvangen om stabiliteit te bereiken.
OPMERKING: Beryllium en boor zijn: uitzonderingen op de octetregel, omdat ze respectievelijk stabiel worden met 4 en 6 elektronen in de valentieschil.
Het aantal elektronen in de valentieschil kan eenvoudig worden bepaald door de familie van de chemische elementen te analyseren. In de onderstaande tabel hebben we het aantal elektronen in de valentieschil dat verwijst naar de familie waartoe het element behoort en het aantal elektronen dat het moet ontvangen om stabiliteit te bereiken:

d) Covalente bindingsprincipevalent
Net als bij de covalente binding hebben alle betrokken atomen de neiging om verplicht elektronen te ontvangen, er zal tussen hen een verdeling zijn van de elektronen die aanwezig zijn in de valentieschil (het niveau dat het verst van de kern verwijderd is).
Delen vindt plaats wanneer een elektron uit de valentieschil van een atoom deel gaat uitmaken van dezelfde elektronische wolk die een ander elektron uit de valentieschil van een ander atoom omringt.
Elk waterstofatoom heeft bijvoorbeeld een elektron in de valentieschil. Wanneer twee elektronen deel gaan uitmaken van dezelfde wolk, begint elke waterstof twee valentie-elektronen te krijgen, dat wil zeggen, het stabiliseert.
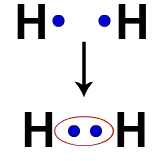
Elektronen van twee waterstofatomen die dezelfde elektronenwolk bezetten
e) Formules die worden gebruikt bij covalente binding
1ª) moleculaire formule
Het is de aanduiding van het aantal atomen van elk element dat het molecuul vormt dat afkomstig is van covalente bindingen.
Voorbeeld: H2O
In het watermolecuul hebben we 2 waterstofatomen en 1 zuurstofatoom.
2ª) structurele Formule
De structuurformule is de demonstratie van de organisatie van het molecuul, dat wil zeggen, het toont de bindingen tussen atomen. Hiervoor worden streepjes gebruikt die de binding van elk atoom vertegenwoordigen:
Eenvoudig (?): Geeft aan dat het atoom slechts één elektron uit zijn valentieschil deelde met een ander atoom en vice versa;
Dubbel (?): Geeft aan dat het atoom twee elektronen van zijn valentieschil deelde met het andere atoom en vice versa;
Triple (≡): geeft aan dat het atoom drie elektronen uit zijn valentieschil heeft gedeeld met een ander atoom en vice versa.
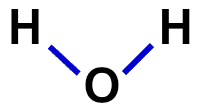
Structuurformule van water
3ª) De elektronische formule van Lewis
De elektronische Lewis-formule vertegenwoordigt ook de organisatie van het molecuul (elektronische formule), maar het is bedoeld om het delen van elektronen in atomen aan te tonen.
Om het te bouwen, volstaat het om de in een structuurformule voorgestelde organisatie te respecteren en elk spoor van de bindingen (enkel, dubbel of drievoudig) te vervangen door "twee ballen", die de elektronen vertegenwoordigen.
In de structuurformule van water hebben we bijvoorbeeld twee eenvoudige bindingen tussen waterstof en zuurstof. Dus tussen hen hebben we slechts twee ballen, begrensd door een ellips (die de elektronische wolk vertegenwoordigt).
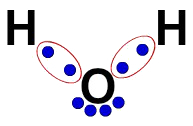
Lewis' elektronische formule van water
Door mij Diogo Lopes Dias
Bron: Brazilië School - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ligacao-covalente.htm
