Koolwaterstoffen, ook wel waterstofcarbiden, zijn organische verbindingen waarvan de samenstelling alleen atomen van koolstof (C) en van waterstof (H), dus met de algemene formule CXHja.
Een koolwaterstof bestaat uit een koolstofstructuur waaraan waterstofatomen binden in covalente binding.
Het is de belangrijkste verbinding in de organische chemie.
Alle soorten koolwaterstoffen oxideren gemakkelijk, waardoor warmte vrijkomt. De meeste zijn niet oplosbaar in water.
Natuurlijke koolwaterstoffen zijn chemische verbindingen die in de aarde worden gevormd (meer dan 150 km van diepte) bij hoge druk en bereiken via geologische processen zones met een lagere druk.
Waar worden koolwaterstoffen gevonden?
De belangrijkste bron van koolwaterstoffen is olie. Hierdoor is de koolwaterstof aanwezig in verschillende derivaten zoals: kerosine, paraffine, natuurlijk gas, Benzine, Vaseline, diesel olie, LPG (Vloeibaar petroleum gas), polymeren (zoals plastic en rubber), onder andere.
Deze organische verbinding vormt 48% van de Braziliaanse energiematrix.
De koolstofketen die deel uitmaakt van de samenstelling van een koolwaterstof is: vierwaardig, dat wil zeggen, het kan vier verbindingen maken.
Koolstof kan zich binden met andere koolstofatomen en met waterstofatomen door middel van eenvoudige links, verdubbelt of verdrievoudigen.
Classificatie van koolwaterstoffen
De classificatie van koolwaterstoffen is gebaseerd op drie specifieke kenmerken: a het formulier van de belangrijkste koolstofketen, de Verbindingen van de koolstofketens, de aanwezigheid van alkylradicalen in de koolstofketen en aanwezigheid van heteroatomen de koolstofketen verdelen.
meer weten over waterstof.
Hoofdvorm van koolstofketen:
Wat betreft de vorm van de hoofdkoolstofketen is de indeling van koolwaterstoffen onderverdeeld in: alifatisch en cyclisch.
Controleer waar elk van deze vormen van koolstofketen uit bestaat.
alifatische koolwaterstoffen
Alifatische koolwaterstoffen worden gevormd door koolstofketens Open of acyclisch. In deze ketens zijn koolstofatomen terminals.
Voorbeelden:
alkaan
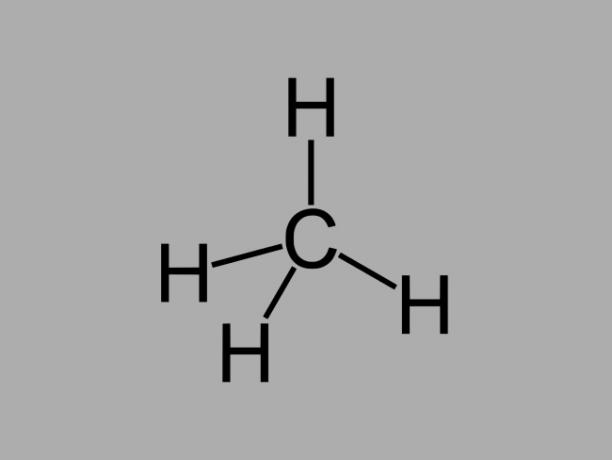
Alkaankoolwaterstoffen, ook wel genoemd paraffines of paraffinehoudend, zijn olieachtige verbindingen waar er slechts enkele bindingen tussen koolstoffen zijn.
De algemene formule voor een alkaan is CNeeH2Nee + 2 (n = elk geheel getal).
alkeen
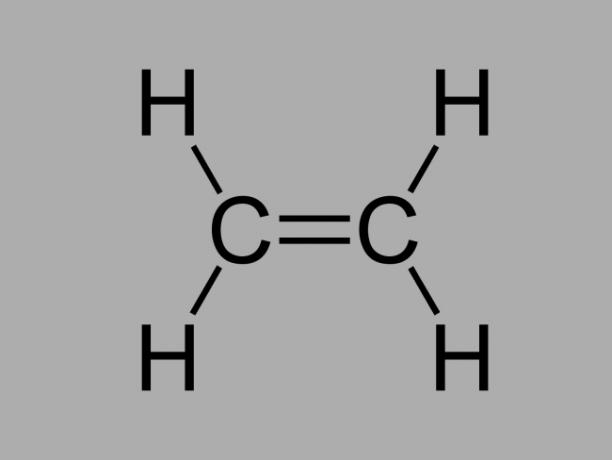
Ook wel genoemd olefine, alkeen of ethyleen koolwaterstof, alkeen is een slecht reactieve verbinding waarbij er een dubbele binding is tussen de koolstoffen.
De algemene formule voor een alkeen is CNeeH2Nee.
alkyn
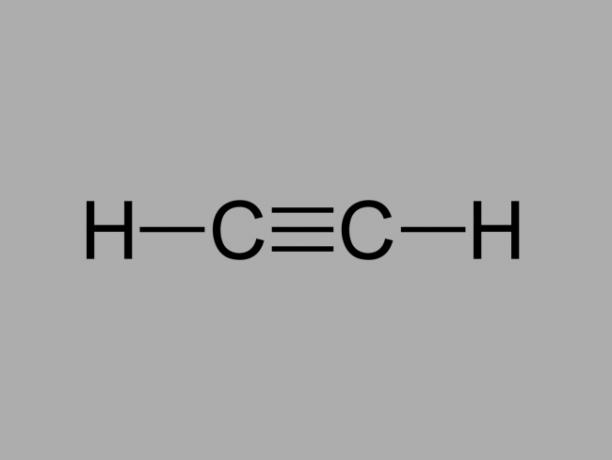
Ook wel genoemd methylacetyleen, alkyn is een koolwaterstof waarbij de bestaande bindingen tussen koolstoffen drievoudig zijn.
De algemene formule voor een alkyn is CNeeH2Nee-2.
alkadieen

Ook wel dienen of dialkenen genoemd, alkadiënen zijn koolwaterstoffen waarbij de bindingen tussen de koolstoffen dubbel zijn.
De algemene formule voor een alkadieen is CNeeH2Nee-2.
cyclische koolwaterstoffen
Cyclische koolwaterstoffen worden gevormd door gesloten of cyclische koolstofketens. Deze ketens hebben geen eindkoolstof.
Voorbeelden:
Cyclaan
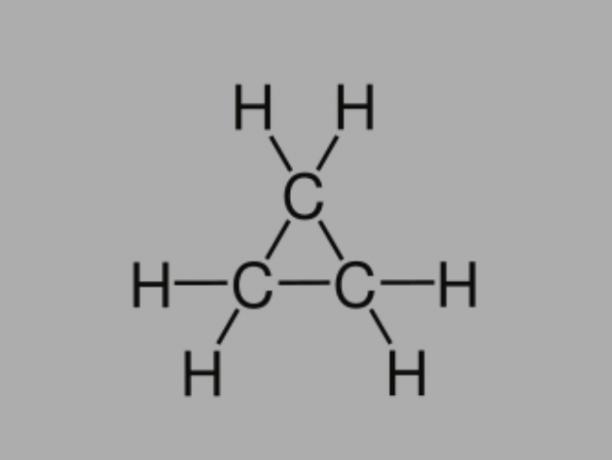
Ook wel genoemd cycloalkaan, cycloparaffine of nafteenhoudende koolwaterstof, cyclaan is een verzadigde koolwaterstof, samengesteld uit enkele bindingen.
Het heeft een gesloten koolstofketen en de algemene formule is CNeeH2Nee.
Cycloonisch

Ook wel genoemd cycloalkenen, cyclenen zijn onverzadigde koolwaterstoffen, samengesteld uit dubbele bindingen.
Een cyclene heeft een gesloten koolstofketen en de algemene formule is CNeeH2Nee−2.
fietser
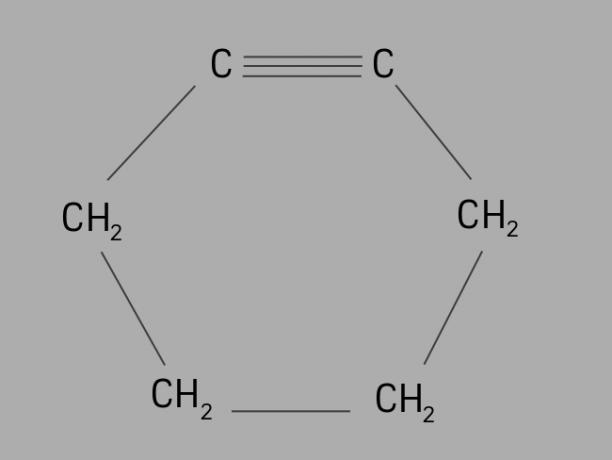
Ook wel genoemd cycloalkyn of cycloalkyn, cycline is een cyclische en onverzadigde koolwaterstof.
Het wordt gevormd door een gesloten koolstofketen, met drievoudige bindingen en de algemene formule is CNeeH2Nee-4.
Aromatisch

of

Ook wel genoemd arena's, aromatische koolwaterstoffen zijn onverzadigde verbindingen gevormd door dubbele bindingen.
Een aromatisch heeft een gesloten of cyclische koolstofketen en de algemene formule is C6H6.
Type binding van koolstofketens
Afhankelijk van het type koppeling van de koolstofketens, kunnen koolwaterstoffen worden ingedeeld in: verzadigd of onverzadigd.
Zie hieronder waar elk van deze classificaties uit bestaat.
Verzadigde koolwaterstoffen
Verzadigde koolwaterstoffen worden gevormd door: eenvoudige links.
Voorbeelden: alkanen, cyclanen.
onverzadigde koolwaterstoffen
Onverzadigde koolwaterstoffen worden gevormd door dubbele bindingen of verdrievoudigen.
Voorbeelden: alkenen, alkynen, alkadiënen.
Aanwezigheid van alkylradicalen
Wat betreft de aanwezigheid van alkylradicalen, kunnen koolwaterstoffen een koolstofketen hebben normaal of vertakt.
normale koolstofketen
Een koolwaterstof met een normale koolstofketen heeft geen alkylradicalen.
Voorbeeld: pentaan
vertakte koolstofketen
Wanneer een koolwaterstof een vertakte koolstofketen heeft, betekent dit dat de belangrijkste koolstofketen alkylradicalen heeft.
Voorbeeld: methylpropaan
Aanwezigheid van heteroatomen die de koolstofketen verdelen
De opeenvolgende koolstofketen kan al dan niet worden gesplitst, afhankelijk van de aanwezigheid van heteroatomen.
Homogene koolstofketen
Wanneer een koolwaterstof een homogene hoofdkoolstofketen heeft, betekent dit dat deze keten is niet verdeeld door heteroatomen.
Heterogene koolstofketen
Als een koolwaterstof een heterogene hoofdkoolstofketen heeft, had deze keten zijn gespleten koolstofketen door een heteroatoom.
Nomenclatuur van koolwaterstoffen
De nomenclatuur van koolwaterstoffen wordt gedefinieerd door een combinatie van drie delen:

Het voorvoegsel identificeert de hoeveelheid koolstoffen, het tussenproduct identificeert het type binding en het achtervoegsel geeft de functie aan waartoe de verbinding behoort (in dit geval de klasse van koolwaterstoffen).
Zie hieronder voor de lijst van voorvoegsels en tussenproducten die worden gecombineerd om koolwaterstoffen aan te duiden.
Lijst met voorvoegsels
| Aantal koolstoffen | Voorvoegsel |
|---|---|
| 1 | Leerde kennen- |
| 2 | et- |
| 3 | prop- |
| 4 | Maar- |
| 5 | pen- |
| 6 | Hex- |
| 7 | Hept- |
| 8 | okt- |
| 9 | Niet- |
| 10 | december- |
Lijst met tussenpersonen
| Connectie type | Tussenpersoon |
|---|---|
| Gewoon enkele oproepen | -een- |
| Paar | -nl- |
| verdrievoudigen | -in- |
| twee paar | -dien- |
Bekijk enkele voorbeelden van naamgeving van koolwaterstoffen.
Voorbeelden:
CH3 – CH2 – CH2 – CH3
In de bovenstaande structurele vorm kunnen we een 4-koolstofverbinding zien die alleen enkele bindingen heeft (aangegeven met het symbool "-").
- Prefix voor 4 koolstofatomen = maar-
- Intermediair voor enkele binding= -an-
- Achtervoegsel van een koolwaterstof= -o
Zie dat de unie van voorvoegsel + tussenvoegsel + achtervoegsel geeft aanleiding tot de naam BUTAAN.
CH2 = CH2
De structurele vorm hierboven heeft 2 koolstofatomen en 1 dubbele binding (aangegeven door het symbool "=").
- Prefix voor 2 koolstoffen = et-
- Intermediair voor dubbele bindingen= -en-
- Achtervoegsel van een koolwaterstof= -o
Zie dat de unie van voorvoegsel + tussenvoegsel + achtervoegsel geeft aanleiding tot de naam ETHENE.
CH2 = CH - CH2 – CH3
CH3 – CH = CH2 – CH3
Merk op dat beide bovenstaande structurele vormen 4 koolstofatomen en 1 dubbele binding hebben (aangegeven door het symbool "=").
Zo hebben we:
- Prefix voor 4 koolstofatomen = maar-
- Intermediair voor dubbele bindingen= -en-
- Achtervoegsel van een koolwaterstof= -o
Zie dat de unie van voorvoegsel + tussenvoegsel + achtervoegsel zou aanleiding geven tot de naam BUTEEN voor de twee structuurvormen.
Merk echter op dat de structurele vormen niet identiek zijn, dus de nomenclaturen kunnen dat ook niet zijn.
Het verschil tussen de twee structurele vormen ligt in de locatie van de dubbele binding.
In dit geval moeten we de koolstofatomen in de keten nummeren vanaf het uiteinde dat het dichtst bij het dubbele ligt. Daarom moeten we in de gevallen in kwestie van links naar rechts nummeren.
In CH2 = CH - CH2 – CH3:
- CH2 zal de 1 zijn
- CH wordt de 2
- CH2 wordt de 3
- CH3 wordt de 4
Merk op dat de dubbele binding is tussen de koolstof 1 het is de koolstof 2.
We moeten het kleinste getal (1) gebruiken om de dubbele binding te vinden: BUTEEN -1
In CH3 – CH = CH2 – CH3:
- CH3 zal de 1 zijn
- CH wordt de 2
- CH2 wordt de 3
- CH3 wordt de 4
Merk op dat de dubbele binding tussen de koolstof 2 het is de koolstof 3.
We moeten het kleinste getal (2) gebruiken om de dubbele binding te vinden: BUTEEN -2
Volgens IUPAC (Internationale Unie van Pure en Toegepaste Chemie – International Union of Pure and Applied Chemistry), moet de locatie iets voor de. worden aangegeven gelokaliseerd zijn (in het geval van de structurele formaliteiten hierboven, de dubbele binding, voorgesteld door de tussenliggende) "-en-").
Daarmee hebben we een tweede manier, die overigens de meest correcte is, om de nomenclatuur van de beschikbare structurele vormen te schrijven.
CH2 = CH - CH2 – CH3: BUTEEN -1 of BUT-1-ENO (juiste vorm)
CH3 – CH = CH2 – CH3: BUTEEN -2 of BUT-2-ENE (juiste vorm)
Leer meer over IUPAC en nomenclatuur.
