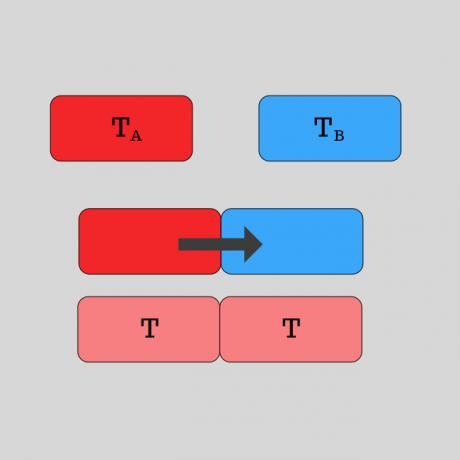
Kationen en anionen zijn soorten ionen, dat wil zeggen atomen die elektronen hebben gewonnen of verloren door chemische bindingen.
Een atoom met hetzelfde aantal protonen (positieve lading) en elektronen (negatieve lading) wordt als elektrisch neutraal beschouwd. Wanneer dit atoom elektronen accepteert of overdraagt, wordt het een ion genoemd dat op zijn beurt kan zijn:
- Kation: Atoom dat elektronen heeft verloren (of opgegeven) en daarom positief geladen is.
- Anion: Atoom dat elektronen heeft gekregen (of geaccepteerd) en daarom negatief geladen is.
Kation
Een kation is een atoom dat een positieve lading heeft omdat het meer protonen dan elektronen heeft.
Alkalimetalen (lithium, natrium, kalium, rubidium, cesium en francium) hebben de neiging om kationen te vormen omdat ze maar 1 elektron in hun valentieschil hebben. Dit betekent dat de energie die nodig is om dit elektron te verwijderen erg laag is, waardoor deze elementen zeer reactief zijn.
Een kation wordt weergegeven door het symbool +, na de naam van het element. De hoeveelheid verloren elektronen geeft het type kation aan:
- Kationen met een +1 lading worden monovalenten genoemd.
- Kationen met een lading van +2 worden bivalenten genoemd.
- Kationen met een lading van +3 worden trivalenten genoemd.
Kationtypen kunnen ook worden geïdentificeerd aan de hand van het aantal signalen +. Dus een element dat alleen wordt vertegenwoordigd door + is een eenwaardig kation, terwijl een ander vertegenwoordigd door +++ is een driewaardig kation.
Voorbeelden van kationen
- Al+3 (Aluminium)
- Hier+2 (Calcium)
- mg+2 (Magnesium)
- Bij+1 (Natrium)
- K+1 (Kalium)
- Zn+2 (Zink)
- Pb+4 (Lood)
anion
Een anion is een atoom dat een negatieve lading heeft omdat het meer elektronen dan protonen heeft. De elementen van de families stikstof, chalcogenen en halogenen hebben de neiging om anionen te vormen omdat ze gemakkelijk elektronen kunnen opnemen.
Een anion wordt weergegeven door het symbool -, na de naam van het element. De hoeveelheid ontvangen elektronen geeft het type anion aan:
- Anionen met een lading van -1 worden monovalenten genoemd.
- Anionen met een lading van -2 worden bivalenten genoemd.
- Anionen met een lading van -3 worden trivalenten genoemd.
Net als bij kationen kunnen anionen ook worden geïdentificeerd aan de hand van de hoeveelheid signalen -. Daarom is een element alleen vertegenwoordigd door - is een eenwaardig anion, terwijl een ander vertegenwoordigd door - - is een tweewaardig anion.
Voorbeelden van anionen
- O-2 (Zuurstof)
- nee-3 (Azide)
- F-1 (Fluoride)
- br-1 (Bromide)
- zo-2 (Zwavel)
- kl-1 (Chloride)
Ionische bindingen
Ionische bindingen of elektrovalente bindingen zijn bindingen die optreden tussen kationen en anionen.
Elementen kunnen elektronen accepteren, weggeven of delen op zo'n manier dat hun laatste energieschil 8 elektronen heeft. Dit staat bekend als de Octettheorie.
Volgens de Octet-theorie hebben atomen de neiging om te stabiliseren wanneer er 8 elektronen in de valentieschil (laatste elektronenschil) zijn. Dus, omdat ze positief geladen zijn, binden kationen aan negatief geladen anionen. Op deze manier geven atomen elektronen af of accepteren ze om een evenwicht te bereiken.
De bindingen die worden gevormd tussen kationen en anionen zijn erg sterk en hebben de volgende kenmerken:
- ze zijn vast en bros onder normale omstandigheden van temperatuur en druk;
- hebben zeer hoge smelt- en kookpunten;
- het beste oplosmiddel is water;
- wanneer opgelost in vloeistoffen, geleiden ze een elektrische stroom.
Ionische bindingen geven aanleiding tot ionische verbindingen, zoals natriumchloride (keukenzout), gevormd door de Na-binding+ (natriumkation) + Cl- (chloride-anion) → NaCl.
Voorbeelden van ionische verbindingen
Enkele voorbeelden van ionische verbindingen zijn:
- NaCl - Natriumchloride (keukenzout)
- Bij2ENKEL EN ALLEEN4 - Sodium sulfaat
- CaCO3 - Calciumcarbonaat
- NaNO3 - Natriumnitraat
Kationentabel
| lezen+ | Lithium | Geloof+2 | ijzerhoudend |
|---|---|---|---|
| Bij+ | Natrium | Co+2 | kobalt |
| K+ | Kalium | Ni+2 | vernikkeld |
| Rb+ | Rubidium | Yn+2 | blikkerig |
| Cs+ | Cesium | Pb+2 | Plumbus |
| (NH4)+ | Ammonium | Mn+2 | Mango |
| Ag+ | Zilver | Pt+2 | platina |
| kont+ | Koper | Bi+3 | Bismut |
| Hg+ | mercurial | Al+3 | Aluminium |
| Au+ | aurorous | Cr+3 | Chroom |
| mg+2 | Magnesium | Au+3 | Auric |
| Hier+2 | Calcium | Geloof+3 | ferric |
| Dhr+2 | Strontium | Co+3 | kobalt |
| Ba+2 | Barium | Ni+3 | nikkel |
| Zn+2 | Zink | Yn+4 | Stannic |
| CD+2 | Cadmium | Pb+4 | loodgieter |
| kont+2 | cupric | Mn+4 | mangaan |
| Hg+2 | kwik | Pt+4 | platina |
anion tafel
| F- | Fluoride | P2O7-4 | Pyrofosfaat |
|---|---|---|---|
| kl- | Chloride | (BIJ DE2)- | Nitriet |
| br- | Bromide | (BIJ DE3)- | Nitraat |
| ik- | jodide | zo-2 | sulfide |
| (ClO)- | Hypochloriet | (ENKEL EN ALLEEN4)-2 | sulfaat |
| (CLO2)- | Chloriet | (ENKEL EN ALLEEN3)-2 | sulfiet |
| (CLO3)- | Chloraat | (S2O3)-2 | Thiosulfaat |
| (CLO4)- | perchloraat | (S4O6)-2 | persulfaat |
| (BrO)- | Hypobromiet | (MnO4)- | permanganaat |
| (BrO3)- | bromaat | (MnO4)-2 | manganaat |
| (IO)- | hypojodiet | (SiO3)-2 | metasilicaat |
| (IO3)- | jodaat | (SiO4)-4 | Orthosilicaat |
| (IO4)- | Periodaat | (CrO4)-2 | chromaat |
| (CN)- | Cyanide | (CrO7)-2 | dichromaat |
| (CNO)- | cyanaat | (ASO3)-3 | arseniet |
| (CZS)- | Thiocyanaat | (ASO4)-3 | Arsenaat |
| (Ç2H3O2)- | Acetaat | (SbO3)-3 | antimoon |
| (CO3)-2 | Carbonaat | (SbO4)-3 | antimoon |
| (Ç2O4)-2 | oxalaat | (BO3)-3 | boraat |
| [Fe(CN)6]-3 | Ferricyanide | (SnO3)-2 | stannaat |
| [Fe(CN)6]-4 | ferrocyanide | (SnO2)-2 | blik |
| (STOF3)- | Metafosfaat | (Hallo2)- | Aluminaat |
| (H2STOF2)- | Hypofosfiet | (PbO2)-2 | Plumbito |
| (HPO3)-2 | Fosfiet | (ZnO2)-2 | Zink |
| (STOF4)-3 | orthofosfaat |
Zie ook:
- Molecuul
- ionen
- chemische energie
- ioniserend