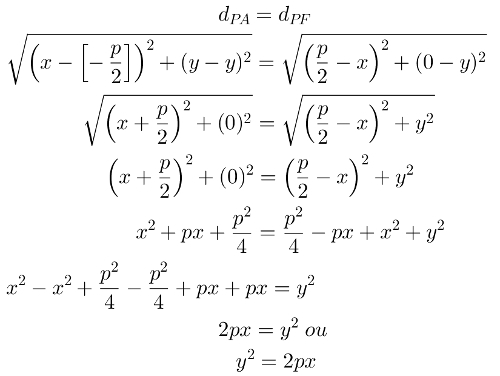valentie laag het is de buitenste laag (of niveau) (het verst van de kern) van een atoom, dat wil zeggen, het verst van de kern. Daarom heeft het de zogenaamde buitenste elektronen of valentie-elektronen.
Het aantal niveaus dat een atoom kan hebben varieert van 1 tot 7, die de volgende subniveaus hebben (in geel):
niveau K (1e laag): subniveau zo
niveau L (2e laag): subniveaus zo en P
niveau M (3e laag): subniveaus zo, P en d
niveau N (4e laag): subniveaus zo, P, d en f
niveau O (5e niveau): subniveaus zo, P, d en f
P-niveau (6e niveau): subniveaus zo, P en d
niveau Q (1e laag): subniveaus zo en P
Elk van de subniveaus bevat een ander aantal elektronen. Kijken:
subniveau s bevat maximaal 2 elektronen;
subniveau p bevat maximaal 6 elektronen;
subniveau d bevat maximaal 10 elektronen;
subniveau f bevat maximaal 14 elektronen.
Dus als de valentieschil van een bepaald atoom M is, is het maximale aantal elektronen dat kan daarin aanwezig zijn zijn 18 (2 elektronen van het s-subniveau + 6 elektronen van het p-subniveau + 10 elektronen van het subniveau d).
Om de valentieschil van een atoom te bepalen en hoeveel elektronen het heeft, zijn er twee manieren, namelijk:
→ Bepaling van de valentieschil en het aantal elektronen uit elektronische distributie
Elektronische distributies vinden altijd plaats via de Linus Pauling-diagram, hieronder weergegeven:

Weergave van een Linus Pauling-diagram
gewone atoomnummer (wat het aantal elektronen in een atoom aangeeft), doen we de elektronische distributie. Bijvoorbeeld een atoom met atoomnummer 50:

Elektronische distributie van het atoom met atoomnummer gelijk aan 50
Als we de bovenstaande verdeling analyseren, zien we dat het niveau dat het verst van de kern ligt, het 5e (N-niveau) is, waarin we de aanwezigheid hebben van 4 elektronen (twee in het s-subniveau en 2 in het p-subniveau).
→ Bepaling van de valentieschil en het aantal elektronen uit het periodiek systeem
De tabel is gerangschikt in perioden (horizontale kolommen), die het aantal niveaus van een atoom aangeven, en groepen of families (verticale kolommen). De periode wordt gebruikt om de te bepalen valentie laag, en de families worden gebruikt om het aantal elektronen te bepalen.
a) De periode van het chemische element kennen
Het periodiek systeem geeft in totaal zeven perioden weer, welk aantal gerelateerd is aan het aantal niveaus dat aanwezig is in het Linus Pauling-diagram. Dus als we de periode weten waarin de chemish element het wordt automatisch in de tabel gevonden, we weten hoeveel niveaus je atomen hebben, waarbij de valentielaag het niveau is dat het verst van de kern verwijderd is.
1e voorbeeld: scheikundig element Kalium
Kalium bevindt zich in de vierde periode van het periodiek systeem, dus het atoom heeft vier niveaus, waarbij het vierde niveau de valentielaag is, wat wordt bevestigd door de distributie ervan elektronica.

Elektronische distributie van element kalium
2e voorbeeld: scheikundig element Fluor
Fluor bevindt zich in de tweede periode van het periodiek systeem, dus het atoom heeft er twee niveaus, waarbij het tweede niveau de valentielaag is, die wordt bevestigd door de distributie ervan elektronica.

Elektronische distributie van het fluorelement
3e voorbeeld: indium scheikundig element
Niet stoppen nu... Er is meer na de reclame ;)
De indiaan bevindt zich in de vijfde periode van het periodiek systeem, dus zijn atoom heeft vijf niveaus, waarbij het vijfde niveau de valentielaag is, wat wordt bevestigd door zijn distributie elektronica.

Elektronische distributie van het Indium-element
b) De familie of groep van het chemische element kennen
Als we de familie of groep kennen waarin het element zich bevindt, weten we ook het aantal elektronen dat aanwezig is in de valentieschil van dat element.
Elementen van familie A
De elementen van families A zijn gepositioneerd in kolommen 1, 2, 13 tot 18 van het periodiek systeem. Elk van deze kolommen krijgt een nummer (1 tot 8, Romeins cijfer), dat precies het aantal elektronen in de valentieschil van deze elementen aangeeft:
Kolom 1 - IA-familie = hebben allemaal 1 elektron in de valentieschil;
Kolom 2 - familie IIA = hebben allemaal 2 elektronen in de valentieschil;
Kolom 3 - familie IIIA = hebben allemaal 3 elektronen in de valentieschil;
Kolom 4 - IVA-familie = hebben allemaal 4 elektronen in de valentieschil;
Kolom 5 - VA-familie = hebben allemaal 5 elektronen in de valentieschil;
Kolom 6 - VIA-familie = hebben allemaal 6 elektronen in de valentieschil;
Kolom 7 - familie VIIA = hebben allemaal 7 elektronen in de valentieschil;
Kolom 8 - familie VIIIA = hebben allemaal 8 elektronen in de valentieschil.
Zie enkele voorbeelden van de bepaling van het aantal valentie-elektronen van enkele elementen van familie A:
Voorbeeld 1: scheikundig element barium
Barium bevindt zich in de IIA-familie, dus het heeft twee elektronen in de valentieschil, wat wordt bevestigd door de elektronische distributie:

Elektronische distributie van het Barium-element
Voorbeeld 2: Antimoon scheikundig element
Antimoon bevindt zich in de VA-familie, dus het heeft vijf elektronen in de valentieschil, wat wordt bevestigd door de elektronische distributie:

Elektronische distributie van het antimoonelement
Voorbeeld 3: Xenon scheikundig element
Xenon bevindt zich in de VIIIA-familie, dus het heeft acht elektronen in de valentieschil, wat wordt bevestigd door de elektronische distributie.

Elektronische distributie van het Xenon-element
OPMERKING: het enige chemische element dat tot de A-familie behoort dat niet aan de voorgestelde regel voldoet, is helium. Het behoort tot de VIIIA-familie, maar heeft slechts twee elektronen in de valentieschil. Dit komt omdat het atoomnummer 2 is, dus het is onmogelijk voor het om 8 elektronen in de valentieschil te hebben zoals de andere elementen in de familie.

Elektronische distributie van een heliumatoom
Familie B-elementen
De elementen van families B staan in de kolommen 3 tot en met 12 van het periodiek systeem. Naast de A-families zijn er ook acht B-families, die worden weergegeven met Romeinse cijfers. In tegenstelling tot de A-families bepaalt het nummer van de B-familie niet het aantal elektronen in de valentieschil.
Het aantal elektronen in de valentieschil van een element van familie B is altijd gelijk aan 2, ongeacht het atoomnummer en de positie in de tabel. De elektronische distributies van californium (98vgl) en hassius (108hs) bewijs dit:

De elektronische distributie van californium heeft als het meest energieke subniveau de 5f10, en de o van hassius is 6d6. In beide gevallen is het verste subniveau van de kern het zevende niveau en beide hebben twee verdeelde elektronen.
Door mij Diogo Lopes Dias