U Koolwaterstoffen zijn samengesteld gevormd door koolstof (C) en waterstof (H). De flexibiliteit van koolstof, het belangrijkste element van deze verbindingen, bevordert het bestaan van een enorme diversiteit aan structuren Daarom kunnen sommige eigenschappen, zoals smeltpunt en kookpunt, verschillen tussen de ene koolwaterstof en de andere.
Het zijn meestal moleculen apolair, met krachtzo intermoleculaire geïnduceerd dipooltype en dichtheid kleiner dan De uit het water. De identificatie van deze verbindingen kan worden gedaan door middel van de nomenclatuur, die de regels volgt die zijn opgesteld door de International Union of Pure and Applied Chemistry (Iupac).
Lees ook: Koolstof - een van de meest voorkomende elementen in het heelal
Eigenschappen van koolwaterstoffen

Polariteit: koolwaterstoffen zonder de aanwezigheid van heteroatomen zijn apolair.
Intermoleculaire krachten: de bindingen tussen de moleculen van een koolwaterstof zijn van het type geïnduceerde dipool.
smeltpunt en enkokend: ze variëren afhankelijk van de grootte, functie en structurele organisatie van het molecuul.
fysieke toestand: onder normale omstandigheden van temperatuur en druk bevinden koolwaterstoffen met vier of minder koolstofatomen zich in een gasvormige toestand. Die met 5 tot 17 koolstofatomen zijn in vloeibare toestand en koolwaterstoffen met meer dan 17 koolstofatomen zijn vaste stoffen.
Dichtheid: is kleiner dan de dichtheid water, dwz minder dan 1,0 g/cm³.
Reactiviteit: alifatische en onverzadigde koolwaterstoffen zijn slecht reactief; onverzadigde verbindingen reageren eerder met andere moleculen en cyclische koolwaterstoffen met maximaal vijf koolstofatomen zijn zeer reactief.
Niet stoppen nu... Er is meer na de reclame ;)
Classificatie van koolwaterstoffen
de koolwaterstoffen kan worden ingedeeld naar de structurele organisatie van de keten en door de instellingen.onverzadiging is de aanwezigheid van dubbele of drievoudige bindingen tussen koolstofatomen, is het voorkomen van pi-type verbindingen (π). al de takken ze zijn als "takken" bevestigd aan een grotere koolwaterstofstructuur. Cyclische ketens kunnen ook vertakkingen en/of onverzadigingen bevatten - de structurele organisatie van koolwaterstoffen met een gesloten keten vormt polygonen zoals onder andere vierkant, driehoek, hexaan.
Wat betreft de rangschikking van atomen, kan een koolwaterstof een normale of vertakte keten hebben.
→ C koolwaterstofnormale, lineaire of rechte lijn: degene met een string die maar twee uiteinden heeft.

→ C koolwaterstofheeft een hekel aan vertakt: degene met een ketting die meer dan twee uiteinden heeft. Om te weten waar en wat de vestigingen zijn, is het belangrijk om de hoofdketen correct te selecteren. De hoofdketen moet alle onverzadigingen en heteroatomen bevatten (indien aanwezig), net zoals het grootste aantal opeenvolgende koolstofatomen. Koolstoffen die niet in de hoofdketen zitten, zijn vertakkingen.
Voorbeeld:

Met betrekking tot zijn "sluiting" kan een koolwaterstof een gesloten, open of gemengde keten hebben.
→ Keten koolwaterstoffenzo gesloten of cyclisch: die met ketens waarin de atomen zich organiseren en een cyclus, een veelhoek of een aromatische ring vormen (gesloten koolwaterstof met afwisselende onverzadigingen). Heb geen losse eindjes, tenzij er een tak is. Elk hoekpunt van de veelhoek vertegenwoordigt een koolstof en zijn respectieve waterstofbindmiddelen.
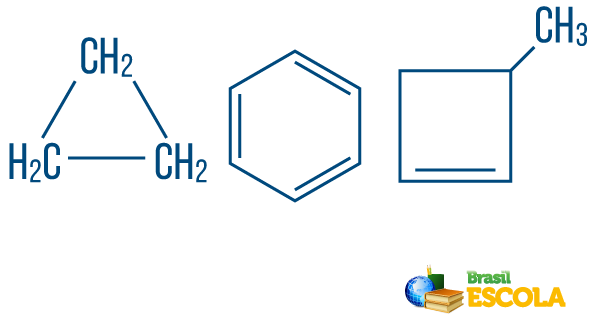
→ Open keten of acyclische koolwaterstoffen: zijn die met kettingen die ten minste twee uiteinden hebben.

→ Koolwaterstof van gemengde type string: wordt gevormd door een ring of cyclische keten bevestigd aan een lineair deel; het heeft ten minste één uiteinde.
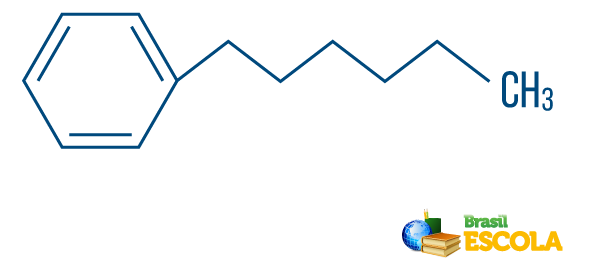
Lees ook: Aromatische koolwaterstoffen - voorbeelden en eigenschappen
Nomenclatuur van koolwaterstoffen
Voor elk type koolwaterstof is er een naamgevingsregel opgesteld door Iupac. De nomenclatuur van deze verbindingen is als volgt gedaan:
1e deel: locatie en naam van filiaal(en) (indien aanwezig);
2e deel: de term is van toepassing fiets als de verbinding een gesloten keten is, maar als het een alifatische (open) keten is, is dit niet nodig;
3e deel: voorvoegsel dat aangeeft hoeveel koolstoffen er in de hoofdketen zitten;
4e deel: locatie en tussenvoegsel indicatief voor het type onverzadiging in het molecuul;
5e deel: achtervoegsel "o" eigen aan koolwaterstoffen.
Als het molecuul een open structuur heeft, zonder vertakking, begint de nomenclatuur in deel 3.
De volgende tabel toont de vereiste informatie (voorvoegsel, tussenvoegsel en achtervoegsel) voor koolwaterstofnomenclatuur in het algemeen. O voorvoegsel varieert met het aantal koolstoffen; O infix, volgens het aantal onverzadigingen; het is de achtervoegsel“O" verwijst naar verbindingen van het koolwaterstoftype.
Voorvoegsel |
Infix |
Achtervoegsel |
||
1 koolstof |
leerde kennen- |
Alleen enkele oproepen |
-een- |
-O |
2 koolstoffen |
et- |
|||
3 koolstoffen |
prop- |
1 dubbele binding |
-nl- |
|
4 koolstoffen |
maar- |
|||
5 koolstoffen |
pen- |
2 dubbele bindingen |
-dien- |
|
6 koolstoffen |
hex- |
|||
7 koolstoffen |
hept- |
1 drievoudige binding |
-in- |
|
8 koolstoffen |
okt- |
|||
9 koolstoffen |
niet- |
2 drievoudige links |
-diin- |
|
10 koolstoffen |
december- |
De eerste stap bij het ontdekken van de nomenclatuur van een organische verbinding is: identificeer de hoofdketen van koolstoffen, die de onverzadigingen en zoveel mogelijk opeenvolgende koolstoffen moeten bevatten. Na het identificeren van de hoofdketen, koolstoffen moeten worden geteld – beginnend met tellen vanaf de kant die het dichtst bij de takken en onverzadigingen (indien aanwezig) ligt. DE lokalisatie zal het nummer van de koolstof zijn waar de vertakking of onverzadiging wordt gevonden. Soms is er maar één mogelijke locatie voor een radicaal of dubbele of driedubbele binding, dus het is niet nodig om de locatie van het verbindende koolstof in de nomenclatuur uit te drukken.

DE nomenclatuur voor takken wordt gegeven door het aantal koolstofatomen in elk, plus beëindiging lijn of ll. Als er meer dan één vestiging is, wordt alfabetische volgorde gebruikt.
Zie de voorbeelden hieronder:
→ voorbeeld 1
CH3 – CH2 – CH3 → Propaan
1e deel: het voorvoegsel “prop-” geeft aan dat de keten drie koolstoffen heeft.
2e deel: het tussenvoegsel "-een-” geeft aan dat het molecuul alleen verbindingen van het type maakt sigma of eenvoudig.
3e deel: het achtervoegsel "-O” is kenmerkend voor koolwaterstoffen.
→ Voorbeeld 2
CH2=CH-CH2-CH3 → Maar-1-een
In koolwaterstoffen met onverzadiging is het noodzakelijk om de koolstof waarin het paar wordt gevonden te nummeren en te lokaliseren, en de nummering moet zo klein mogelijk zijn. Hiervoor moet de koolstoftelling beginnen met de zijde die zich het dichtst bij de dubbele binding bevindt.
1e deel: "maar-" geeft aan dat er vier koolstoffen in de keten zijn.
2e deel: "1-nl" verwijst naar onverzadiging tussen koolstof 1 en 2.
3e deel: "-O" is het karakteristieke achtervoegsel van koolwaterstoffen.
→ Voorbeeld 3

1e deel: "3-ethyl" geeft aan dat er een twee-koolstoftak op koolstof 2 is.
2e deel: "-opgenomen-" geeft de aanwezigheid van vijf koolstoffen in de hoofdketen aan.
3e deel: "-een-" is het tussenvoegsel dat wordt toegepast op onverzadigde ketens (geen dubbele of driedubbele bindingen).
4e deel: "-O" is het karakteristieke achtervoegsel van koolwaterstoffen.
→ Voorbeeld 4
Voor kettingen met meer dan één vestiging, plaats de radicalen in de nomenclatuur in alfabetische volgorde. Als er vertakkingen en onverzadigingen in hetzelfde molecuul zijn, moet de telling van koolstoffen in de hoofdketen zo gebeuren dat de som van de locatienummers zo klein mogelijk is.
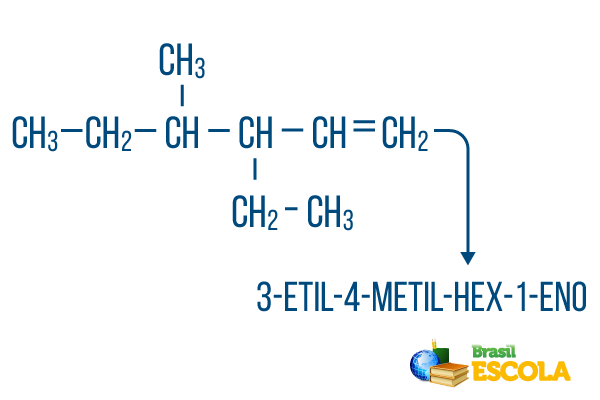
De koolstoftelling van de hoofdketen werd van links naar rechts gedaan en de som van de onverzadigings- en vertakkingslocatienummers is: 1+4+3 = 8. Als de koolstoftelling van rechts naar links was geweest, zou de samengestelde nomenclatuur zijn: 4-ethyl-3-methyl-5-een, waarvan de som van de locaties zou zijn: 4+3+5 = 12, wat groter is dan de andere hypothese, dus het mag niet worden gebruikt.
1e deel: 3-ethyl-4-methyl verwijst naar de radicalen in alfabetische volgorde en hun respectieve locaties.
2e deel: hex- betekent dat er 6 koolstoffen in de hoofdketen zijn.
3e deel: 1-en geeft de aanwezigheid van een dubbele binding op koolstof 1 aan.
4e deel: "-O" is het karakteristieke achtervoegsel van koolwaterstoffen.
→ Voorbeeld 5
Voor gesloten strings gelden de naamgevingsregels, maar het woord fiets begint de naam van de verbinding, wat aangeeft dat het een gesloten of cyclische koolwaterstof is.
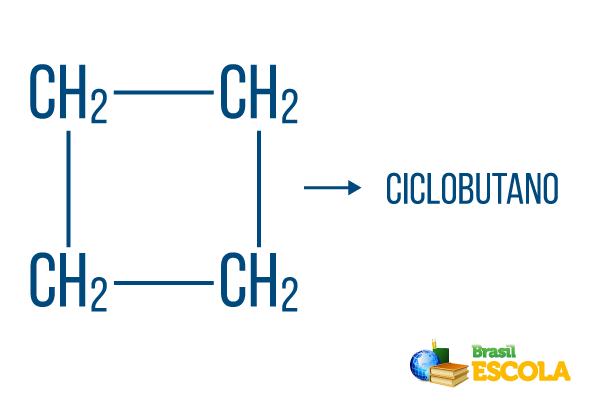
1e deel: fiets- geeft aan dat het een gesloten string is.
2e deel: -maar- geeft het bestaan van 4 koolstoffen in de keten aan
3e deel: -Ois het karakteristieke achtervoegsel van koolwaterstoffen.
Lees ook: Classificatie van koolstofketens
Soorten koolwaterstoffen
Koolwaterstoffen kunnen worden onderverdeeld in alkanen, alkenen, alkynen en alkadiënen - die worden geclassificeerd als volgens de totstandkoming van de keten (dubbele (s) of drievoudige bindingen) - en cyclanen, dit zijn de ketens Gesloten.
→ alkanen: zijn koolwaterstoffen die geen onverzadiging hebben. De algemene formule voor alkanen is CNeeH2n+2, en de Neeomenclatuur het is gecomponeerd door voorvoegsel + een + O.
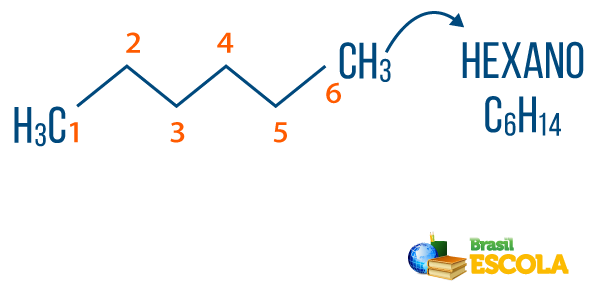
U alkanen is te vinden in de natuur, zoals gas methaan (CH4), dat vrijkomt door dieren en wordt geproduceerd in ontbindingsprocessen, maar ook in raffinaderijen en petrochemische industrieën. Verbindingen zoals propaan (Ç3H7), butaan (Ç4H10), waaruit ons kookgas (LPG) bestaat, en de octaan- (Ç8H18), aanwezig in autobrandstof, zijn bijproducten van Aardolie.

→ alkenen of alkenen: zijn koolstofketens die een onverzadiging hebben, een dubbele binding. De algemene formule is CNeeH2n, en die van jou Neeomenclatuur het is gecomponeerd door Pherstellen + nl + o.

O ethyleengas (Ç2H4), gebruikt in de landbouw om het rijpen van fruit te versnellen, behoort tot de functie: alkeen. De verbinding wordt ook gebruikt bij de productie van grondstoffen polyethyleen, gebruikt bij de vervaardiging van plastic keukengerei.
→ Alkynen of acetyleen: koolwaterstoffen met een drievoudige binding. De algemene formule is CNeeH2n - 2. DE nomenclatuur het is gecomponeerd door voorvoegsel + in + o.

O acetyleen of etine (C2H2) is een gas van de alkynfunctie die wordt gebruikt in lassen en snijden van metaal. Deze compound kan temperaturen tot 3.000 °C bereiken, waardoor reparaties aan ondergedompelde delen van een schip kunnen worden uitgevoerd.

→ alkadiënen of diënen: koolstofketens met twee onverzadigingen, dat wil zeggen twee dubbele bindingen tussen koolstofatomen. De algemene formule voor deze functie is C.NeeH2n - 2. Realiseer je dat het dezelfde formule is als alkynen, wat betekent dat het kan gebeuren isomerie tussen verbindingen (dezelfde molecuulformule voor verschillende verbindingen).
De nomenclatuur van een alkadieen is samengesteld uit: Pherstellen + dien + uit.
Voorbeeld:

→ Gesloten koolwaterstoffen: de moleculen organiseren zichzelf op een cyclische manier, hebben de neiging een veelhoek te vormen en, zoals in open ketens, kunnen er vestigingen en/of vertakkingen zijn. Cyclonen, cyclenes, cyclines en benzenen zijn koolwaterstoffen met een gesloten keten.
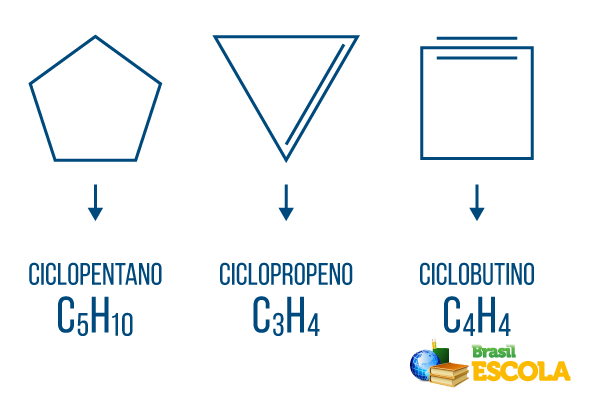
Cyclonen of cycloalkanen: cyclische ketens die alleen uit enkele bindingen bestaan. De algemene formule is CNeeH2n. nomenclatuur: ciclo + voorvoegsel + an + o.
Cycli of cycloalkenen: gesloten koolwaterstofketens met een inrichting. De algemene formule is CNeeH2n-2. Nomenclatuur: çiclo + voorvoegsel + en + O.
-
Cyclinen of cycloalkynen: gesloten keten koolwaterstoffen met de aanwezigheid van twee dubbele bindingen. De algemene formule is CNeeH2n-4. Nomenclatuur: çiclo + voorvoegsel + in + o.
benzenen
benzeen is een type koolwaterstof met een gesloten keten met zes koolstoffen waarbij de bindingen variëren tussen enkel en dubbel. Deze verbindingen zijn: giftig en zeer kankerverwekkend, omdat het wordt gebruikt als organische oplosmiddelen in chemische processen.
Om de koolwaterstof als aromatisch te beschouwen, moet er ten minste één zijn: benzeen ring, die zeer reactief is, daarom onderhevig aan twee of meer vervangingen, die we hier als vertakkingen zullen zien. Als er twee verbindende radicalen zijn, hebben we specifieke namen voor elk paar posities.
Radialen op 1,2 koolstofatomen van benzeen → ortho
Radicalen bij de 1,3 koolstofatomen van benzeen → doel
Radialen op koolstof1,4 van benzeen → voor
De annomenclatuur van een aromatische verbinding wordt als volgt gedaan:
1e deel: positionering van de liganden (ortho, doel of to).
2e deel: naam van de radicaal of radicalen die aan benzeen zijn gehecht (methyl, ethyl, propyl…). De naam die aan radicalen wordt gegeven, volgt de regel van andere koolwaterstoffen.
- 3e deel: -Bvergiftigen, wat de karakteristieke term is van aromatische koolwaterstoffen.
Voorbeelden:
→ Ortho-dimethyl-benzeen

1e deel: Orto- geeft aan dat de radicalen op koolstof 1 en 2 zijn gepositioneerd.
2e deel: -dimethyl- verwijst naar de twee radicalen, beide met één koolstofatoom.
3e deel: -benzeen is de karakteristieke term voor aromatische koolwaterstoffen.
→ Ortho-ethyl-methyl-benzeen
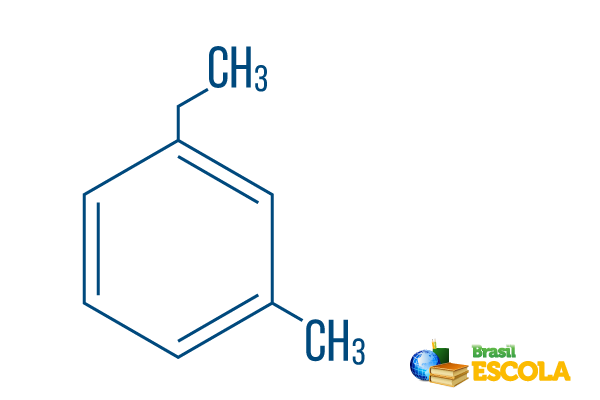
1e deel: mOh- geeft aan dat de radicalen op koolstof 1 en 3 zijn gepositioneerd.
2e deel: ethyl-methyl- verwijst naar de hoeveelheid koolstof in elke radicaal, zijnde: ethyl De twee-koolstoftak en methyl- vertakking met één koolstof - in alfabetische volgorde in de nomenclatuur geplaatst.
3e deel: -benzeen is de karakteristieke term voor aromatische koolwaterstoffen.
→ para-diethyl-benzeen
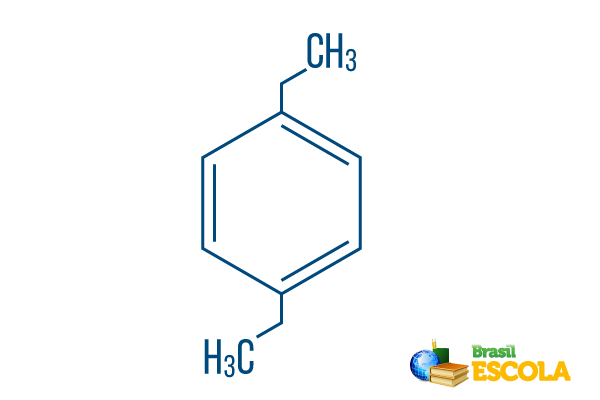
1e deel: Pploeg- geeft aan dat de radicalen op koolstof 1 en 4 van benzeen zitten.
2e deel: -diethyl- verwijst naar twee radicalen van het type ethyl, dat wil zeggen, twee takken met elk twee koolstofatomen.
3e deel: -benzeen is de karakteristieke term voor aromatische koolwaterstoffen.
Lees ook:Ontdekking van de structuur van benzeen
opgeloste oefeningen
(Unesp) – Octaan is een van de hoofdbestanddelen van benzine, een mengsel van koolwaterstoffen. De molecuulformule van octaan is:
een) C8H18
b) C8H16
c) C8H14
d) C12H24
e) C18H38
Antwoord: letter a). Analyse van de samengestelde nomenclatuur octaan, het is een alkaan, dat wil zeggen een molecuul dat alleen uit enkele bindingen bestaat. Als de algemene formule voor alkanen C. isNeeH2n+2, door "n" te vervangen door acht, wat de hoeveelheid koolstoffen in de hoofdketen is - en uniek in dit geval -, zullen we zien dat de molecuulformule van octaan C8H18 is.
(UFSCar-SP) – Beschouw de volgende uitspraken over koolwaterstoffen.
I) Koolwaterstoffen zijn organische verbindingen die alleen uit koolstof en waterstof bestaan.
II) Alleen onverzadigde koolwaterstoffen met rechte keten worden alkenen genoemd.
III) Cycloalkanen zijn verzadigde alifatische koolwaterstoffen met de algemene formule CnH2n.
IV) Zijn aromatische koolwaterstoffen: broombenzeen, p-nitrotolueen en naftaleen.
De volgende stellingen zijn correct:
a) Alleen I en III.
b) Alleen I, III en IV.
c) Alleen II en III.
d) Alleen III en IV.
e) Alleen I, II en IV.
Antwoord: Letter a).
II - Alkenen zijn verbindingen met een dubbele binding, dat wil zeggen onverzadigd, maar ze kunnen vertakkingen in hun keten hebben, niet uitsluitend lineair.
IV - Bromethobenzeen en p-nitrotolueenverbindingen behoren tot andere organische functies.
door Laysa Bernardes
Scheikundeleraar



