O ammonium nitraat is een vaste stof met de molecuulformule NH4BIJ DE3 en wit uiterlijk (wanneer puur). samengesteld Door de ionen NH4+ (ammonium) en NO3- (nitraat), is niet ontvlambaar, maar is sterk oxiderend en reactief. De ontledingsreactie genereert een groot volume aan gassen als het product, waardoor onjuiste opslag van dit product een ernstig probleem wordt, aangezien er explosies kunnen optreden. En ook veel gebruikt in de landbouw als meststof.
Lees ook: Natuurlijke stoffen - moleculen afkomstig uit de natuur
Wat is ammoniumnitraat?

Ammonium nitraat het is een zout gevormd door NH-ionen4+ (ammonium) en NO3- (nitraat). Het is een vaste verbinding die, wanneer puur, het is wit van kleur. Het wordt veel gebruikt als landbouwmeststof, maar het kan ook worden gebruikt bij de vervaardiging van explosieven, zoals: het is een zeer oxiderende stof, dan oxiderend. De op hol geslagen reactie van ammoniumnitraat genereert een hoge afgifte van gassen, veroorzaken explosieve impact.
Niet stoppen nu... Er is meer na de reclame ;)
Kenmerken van ammoniumnitraat
Molaire massa: 80,04336 g/mol.
Zout bestaande uit de ionen: ammonium (NH4+) en nitraat (NO3-).
Uiterlijk: witte vaste stof.
Het is sterk oxiderend.
Reageert gemakkelijk met andere stoffen.
Het is niet ontvlambaar.
Voor normale temperatuur- en drukomstandigheden:
- dichtheid: 1,73 g/cm³;
- kookpunt: 210 °C;
- smeltpunt: 169,6 °C;
- oplosbaarheidsgraad in water: 216 g/100ml;
- pH: 5,5 (0,2M).
Ammoniumnitraatformule
De molecuulformule van deze verbinding is NH4BIJ DE3.
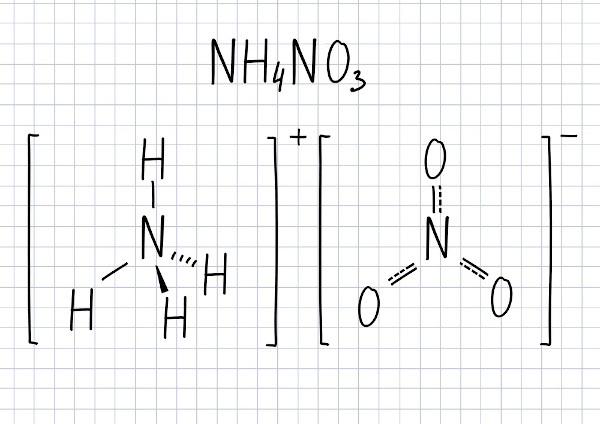
Ontleding van ammoniumnitraat
voor het zijn stof met een hoge reactiviteit en een hoog oxiderend vermogen, ammoniumnitraat veroorzaakt bij blootstelling aan hoge temperaturen een ontledingsreactie:, en de belangrijkste producten zijn gassen, stikstof, zuurstof en waterdamp. De ontleding gebeurt in twee stappen:
→ 1e stap:
2NH4BIJ DE3 (s) → 2N2O(g) + 4H2O(g)
→ 2e etappe:
2N2O → 2N2(g) + O2(g)
→ Globale vergelijking:
2NH4BIJ DE3 (s) → 2N2(g) + O2(g) + 4H2O(g)
Merk op dat in de eerste vergelijking,een van de producten verkregen in de ontbinding is de is lachgas (N2O), ook gekend als lachgas. Het wordt gebruikt om het vermogen van automotoren om brandstof te verbranden te vergroten en als verdovingsmiddel, voornamelijk door tandartsen. Het is ook een van de belangrijkste gassen die verantwoordelijk zijn voor broeikaseffect.
Zie ook: Wat zijn de soorten chemische reacties?
Productie van ammoniumnitraat
Ammoniumnitraat kan worden verkregen door: reactie tussen ammoniumsulfaat (NH4)2ENKEL EN ALLEEN4 en calciumnitraat Ca (NO3)2. Zie hieronder:
(NH4)2ENKEL EN ALLEEN4 + Ca (NEE3)2 → 2 NH4BIJ DE3+ Geval4
Het kan ook worden geproduceerd uit gasvormige ammoniak, die in een salpeterzuuroplossing wordt geborreld, met als reactieproduct het waterige ammoniumnitraat. Kijken:
NH3(g) + HNO3(aq) → NH4BIJ DE3(hier)
Gebruik van ammoniumnitraat

- Kunstmestproductie
- Explosieven in mijnen, steengroeven en de bouw
- Herbiciden en insecticiden
- Het verkrijgen van lachgas voor industriële toepassing
- Absorptiemiddelen voor oxiden
- Oxidant voor raketstuwstoffen
- Vervaardiging van isotherme zakken
- Productie van verdovende rook voor het beheer van netelroos in de bijenteelt
Ook toegang: Hoe een brand te bestrijden?
Gevaren van ammoniumnitraat
Een van de belangrijkste risico's van ammoniumnitraat is onvoldoende opslag. Omdat het een zeer oxiderende stof is en reageert met verschillende andere verbindingen, veroorzaakt het een reactie met het vrijkomen van een grote hoeveelheid gas. Onjuiste opslag is onderhevig aan besmetting met ontvlambare producten, blootstelling aan hitte of gasretentie, wat kan explosies veroorzaken?.
Dat is bijvoorbeeld al gebeurd in Texas, in de Verenigde Staten, met een vrachtschip dat uit Frankrijk kwam aan boord van 2.086 ton ammoniumnitraat. het ongeluk gebeurde in 1947 en werd bekend als de Texas City Ramp. De tragedie veroorzaakte de dood van 581 mensen en het gebeurde als gevolg van een brand die zich niet in het schip bevond en die de ammoniumlading bereikte, waardoor de explosie ontstond.
Een ander voorbeeld was de explosie volgorde wat gebeurde op 4 augustus 2020 in de haven van stad Beiroet, Libanon, het verlaten van meer dan 100 mensen doden en 5.000 gewonden. De omvang van de explosie was te wijten aan de ontsteking van een kettingreactie van de lading van 2.750 ton ammoniumnitraat die daar was opgeslagen.
Het is ook vermeldenswaard dat ammoniumnitraat kan veroorzaken: huid- en oogirritatie en, indien ingeademd, ademhalingsproblemen. In de bloedbaan heeft de stof een giftige kracht, omdat het reageert met lichaamsvloeistoffen, en de producten van deze reactie, zoals nitraat, kunnen schade aan de gezondheid veroorzaken, zoals blauwe babyziekte, ook bekend als infantiele methemoglobinemie (laag hemoglobine in het bloed). Deze ziekte komt steeds vaker voor in gezinnen in landelijke gebieden als gevolg van verontreiniging met ammoniumnitraat, aanwezig in meststoffen, van waterlichamen in het landbouwgebied.
door Laysa Bernardes
Scheikundeleraar
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
ARAúJO, Laysa Bernardes Marques de. "Ammonium nitraat"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/quimica/nitrato-de-amonio.htm. Betreden op 27 juni 2021.
Biologie
Leer meer over de stikstofcyclus, een belangrijke biogeochemische cyclus die zorgt voor de circulatie van dit element. In deze tekst gaan we in op elke stap van de stikstofcyclus, bespreken we het belang ervan en focussen we op de rol van bacteriën in dit proces. We zullen ook oefeningen over het onderwerp presenteren.