Hybridisatie is de naam die wordt gegeven aan de fusie of vereniging van onvolledige atomaire orbitalen, een fenomeen dat het aantal verhoogt covalente bindingen dat een atoom kan doen. Onthoud dat orbitaal het gebied van het atoom is waar de kans groter is om een elektron te vinden.
Het aantal bindingen dat een atoom maakt kennen en het fenomeen van. begrijpen hybridisatie, is het noodzakelijk om enkele fundamentele punten over het atoom te weten:
1O punt: de energiesubniveaus
De energiesubniveaus die een atoom kan hebben zijn s, p, d, f.
2O punt: aantal orbitalen per subniveau
Elk energiesubniveau heeft een ander aantal orbitalen, zoals we hieronder kunnen zien:
Subniveau s: 1 orbitaal;
p subniveau: 3 orbitalen;
Subniveau d: 5 orbitalen.
De generieke weergave van deze orbitalen gebeurt als volgt:
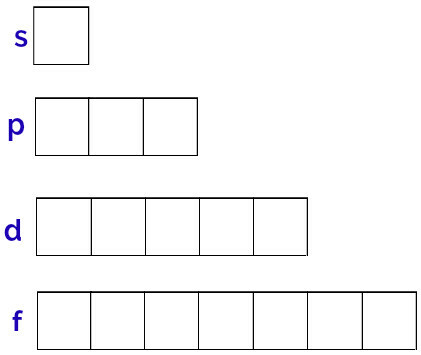
Vertegenwoordiging van de orbitalen van elk subniveau
Volgens Pauli kan een orbitaal maximaal 2 elektronen hebben, met draait (roterende bewegingen) tegenovergesteld.
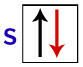
Weergave van de s-orbitaal met zijn elektronen with
Volgens Hund ontvangt een orbitaal van een subniveau zijn tweede elektron pas als alle andere orbitalen van dat subniveau het eerste elektron al hebben ontvangen.
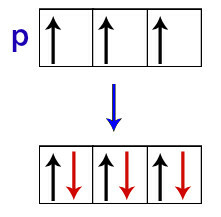
Verdeling van elektronen in p subniveau-orbitalen
3O punt: elektronische distributie
Om hybridisatie en het aantal bindingen dat een atoom maakt te begrijpen, is het essentieel om de elektronische distributie op het Linus Pauling-diagram.

Linus Pauling-diagram
Onthoud dat het maximale aantal elektronen in elk subniveau is:
s = 2 elektronen;
p = 6 elektronen;
d = 10 elektronen;
-
f = 14 elektronen.
Niet stoppen nu... Er is meer na de reclame ;)
Na deze korte bespreking kunnen we nu definiëren: wat is hybridisatie?. Hiervoor gebruiken we het scheikundige element boor (atoomnummer = 5) als voorbeeld.
Wanneer we elektronische boordistributie uitvoeren, hebben we:
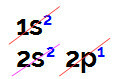
Elektronische boorverdeling in het Linus Pauling-diagram
Het is mogelijk om in deze verdeling waar te nemen dat boor 2 elektronen heeft in het s-subniveau en 1 elektron in het p-subniveau van valentie laag.
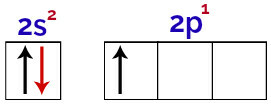
Elektronen in de orbitalen van de boorvalentielaag
Omdat boor 1 onvolledige orbitaal heeft, zou het daarom slechts één covalente binding moeten maken, aangezien het aantal bindingen altijd direct gerelateerd is aan het aantal onvolledige orbitalen.
Dus wanneer het booratoom energie ontvangt van de externe omgeving, worden zijn elektronen, vooral die in de valentieschil, opgewonden. Dit zorgt ervoor dat een van de elektronen uit de s-orbitaal een van de lege p-orbitalen verlaat en inneemt, wat resulteert in 3 onvolledige atomaire orbitalen, zoals je kunt zien in de volgende afbeelding:

Weergave van de aangeslagen toestand van het booratoom
Ten slotte is er de vereniging van de onvolledige s-orbitaal met de onvolledige p-orbitalen. Deze unie heet hybridisatie. Omdat we de fusie van een s-orbitaal met twee p hebben, wordt dit genoemd hybridisatie sp2.
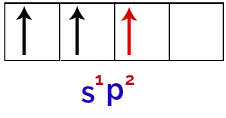
Vertegenwoordiging van gehybridiseerde orbitalen in het booratoom
Naast boor ondergaan verschillende andere chemische elementen het fenomeen van hybridisatie, zoals zwavel (S), Xenon (Xe), fosfor (P), koolstof (Ç), beryllium (Worden).
Door mij Diogo Lopes Dias
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
DAGEN, Diogo Lopes. "Wat is hybridisatie?"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-hibridizacao.htm. Betreden op 27 juni 2021.
Bindingsenergie, Chemische reacties, bindingen verbreken, studie van energievariatie, enthalpievariatie van reacties, energievoorziening, verbreking van de verbinding van reagentia, endotherm proces, energieafgifte, energie die vrijkomt in de vorming

