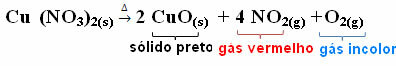Chloriden zijn die ionische verbindingen die het anion bevatten Cℓ-1.
Chloor is van de familie 17 of 7A, het atoomnummer is gelijk aan 17 en het heeft 7 elektronen in de valentieschil (de buitenste elektronenschil van het atoom). Volgens regel van het octet, om stabiel te zijn, moet het 8 elektronen in deze laatste schil hebben, en daarom moet het nog een elektron ontvangen. Wanneer dit gebeurt, dat wil zeggen, wanneer het een elektron ontvangt, in het algemeen, van een ionische binding met een metaal, wordt de â gevormd.ion chloride (Cℓ-1), wordt het metaal dat het elektron opgaf een kation en de gevormde substantie is ionisch.
Chloriden zijn zouten die zijn afgeleid van de reactie van een base met zoutzuur (HCℓ(hier)). De base levert het kation en zoutzuur levert het chloride-ion:
Generieke base + zoutzuur → Chloride + water
ÇOH+HCℓ → ÇCℓ + H2O
Chloriden zijn allemaal geclassificeerd als: anorganische zouten, omdat ze in een waterig medium een ander kation dan H. afgeven+ en laat het chloride-anion vrij, niet de hydroxyl (OH-).
De nomenclatuur van chloriden volgt altijd deze regel: Chloride ++ (naam van element gekoppeld aan chloor). Bij je formules zijn gevormd het uitwisselen van de ionenladingen voor de indices (getal dat rechtsonder in het elementsymbool staat, dat het aantal atomen van dat element aangeeft dat bindingen aangaat).

als de index is "1", u hoeft deze niet in de formule te schrijven, zoals hieronder weergegeven:
Bij+1 Cℓ-1 → Bij1Cℓ1 → BijCℓ: natriumchloride;
K+1 Cℓ-1 → KCℓ: kaliumchloride;
Hier+2 Cℓ-1→CaCℓ2: calciumchloride;
Niet stoppen nu... Er is meer na de reclame ;)
Ba+2 Cℓ-1→Bhier2: bariumchloride;
Aℓ+3 Cℓ-1→ACℓ3: aluminiumchloride.
Echter, zoals uitgelegd in de tekst “Ionische stoffen van de groep: chloride, carbonaat, nitraat en sulfaat”, zoals bij alle ionische stoffen, hebben chloriden hun eenheidsformules niet geïsoleerd in de natuur, omdat hun ionen elkaar wederzijds aantrekken en de kristalroosters vormen.
Het belangrijkste voorbeeld van chloride dat we in ons dagelijks leven hebben, is de natriumchloride, NaCℓ, het tafelzout. Zie de ionische binding die resulteert in de vorming ervan (waarin natrium een elektron afstaat aan chloor) en onder het kristalrooster van dit zout:

In het kristalrooster van natriumchloride elk anion Cℓ- is omgeven door 6 kationen Na+ en vice versa, dus het coördinatiegetal van dit kristalrooster is 6.
Alle chloriden zijn vaste stoffen in omgevingsomstandigheden en vrij in water oplosbaar, behorend tot de meest voorkomende zouten in ons dagelijks leven, aangezien een aantal van hen of zijn aanwezig opgelost in mineraalwater, drinkwater, leidingwater, rivieren, zeeën, o.a anderen. Een van de uitzonderingen, zijnde in water onoplosbare chloriden, zijn zilverchloride (AgCℓ - weergegeven in de volgende afbeelding), van lood, koper en kwikverbindingen.

In water onoplosbaar zilverchloride*
De Cℓ-ionen-1 van de chloriden die we binnenkrijgen, voornamelijk in de zout, vis en vlees, zijn belangrijk voor sommige functies van het menselijk lichaam, omdat ze het belangrijkste extracellulaire anion zijn, aanwezig zijn in het sap maag, reguleren lichaamsvloeistoffen, zoals waterdistributie in het lichaam, en handhaven plasma-osmotische druk en neutraliteit elektrisch.
Het tekort kan angst, diarree en problemen met de bloedsomloop veroorzaken. Het overschot wordt uitgescheiden via de urine (gemiddeld scheidt elke persoon ongeveer 4 g chloride per dag uit), zweet en uitwerpselen.
*Afbeelding tegoed: Schrijver: Danny S. / Afbeelding geëxtraheerd uit: Wikimedia Commons
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
FOGAÇA, Jennifer Rocha Vargas. "Chloriden"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/quimica/cloretos.htm. Betreden op 28 juni 2021.
Chemie

Alledaagse zouten, calciumcarbonaat, natriumchloride, natriumfluoride, kaliumnitraat, natriumnitraat natrium, natriumcarbonaat, natriumbicarbonaat, natriumbicarbonaat, natriumsulfiet, salpeter, Frisdrank.