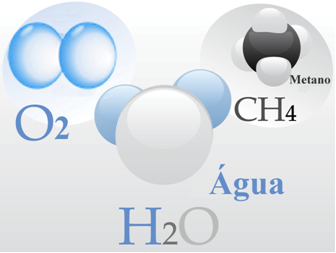
Bij moleculen het zijn structuren met een bepaalde molecuulmassa en een relatief klein en exact aantal atomen die covalent aan elkaar zijn gebonden, dat wil zeggen door het delen van elektronen.
Zie drie voorbeelden:
- Zuurstofgas: De moleculen worden elk gevormd door een dubbele binding, dat wil zeggen door het delen van twee elektronenparen tussen twee zuurstofatomen (O2);
- Water: het wordt gevormd door H-moleculen2O. Dat betekent dat elk molecuul twee waterstofatomen heeft die een elektronenpaar delen met elk een zuurstofatoom.
- Methaan: deze verbinding wordt gevormd door CH-moleculen4, waarin vier waterstofatomen covalent binden aan één koolstofatoom.
Moleculaire stoffen hebben enkele karakteristieke eigenschappen, zoals:
- Gevarieerde oplosbaarheid in water en andere oplosmiddelen;
- Ze kunnen zichzelf presenteren in de drie fysieke toestanden;
- Over het algemeen zijn het elektrische isolatoren, zowel vast als vloeibaar.
Alle moleculen worden gevormd door niet-metalen elementen, dat wil zeggen dat ze alleen waterstof, niet-metalen en halfmetalen bevatten. Maar deze elementen kunnen ook stoffen vormen die alleen in vaste toestand aanwezig zijn en die eigenschappen hebben die heel anders zijn dan die van moleculen. dit zijn de
macromoleculen.Macromoleculen, ook wel bekend als covalente vaste stoffen of covalente netwerkvaste stoffen,het zijn structuren met een zeer hoge en onnauwkeurige molecuulmassa, naast dat ze worden gevormd door een grote en onbepaalde hoeveelheid atomen die covalent binden om driedimensionale roosters te vormen. De macromoleculen vormen de covalente kristallen of atomaire kristallen.
Niet stoppen nu... Er is meer na de reclame ;)
Koolstofatomen kunnen bijvoorbeeld op veel manieren elektronen delen en veel verschillende eenvoudige stoffen vormen. Deze eigenschap dat hetzelfde scheikundige element twee of meer verschillende enkelvoudige stoffen moet vormen, krijgt de naam allotropie.
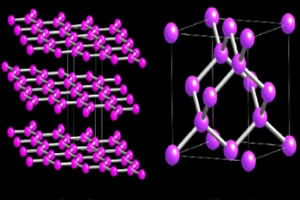
Twee allotrope koolstofvariëteiten die macromoleculen vormen, zijn de Diamant en de grafiet. In de onderstaande afbeeldingen kun je zien dat, in het geval van diamant, elk koolstofatoom zich bindt aan vier andere koolstofatomen en aanleiding geeft tot een macromolecuul met een tetraëdrische structuur.

Ondertussen wordt de grafietstructuur gevormd door zeshoekige ringen in hetzelfde vlak. Koolstofatomen maken een dubbele en twee enkele bindingen.

Maar macromoleculen bestaan niet alleen uit een enkel type element; ze kunnen ook worden gevormd uit atomen van verschillende chemische elementen.
Een voorbeeld is siliciumdioxide (kwarts), waarvan de macromoleculen elk siliciumatoom hebben omgeven door vier koolstofatomen en elk zuurstofatoom gekoppeld aan twee siliciumatomen.
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
FOGAÇA, Jennifer Rocha Vargas. "Moleculen en macromoleculen"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/quimica/moleculas-macromoleculas.htm. Betreden op 28 juni 2021.
Chemie
Wat is allotropie, eenvoudige stoffen, gaszuurstof, ozon, allotrope vormen, chemisch element zuurstof, ultraviolette stralen van de zon, diamant, grafiet, atomiciteit, witte fosfor.
Ruimtelijke formule van koolstof, elektronische formule van Lewis, vlakke structuur, elektronische paren, binding covalent, valentielaag, evolutie van het atoommodel, molecuulformule, structuurformule, formules driedimensionaal.
Chemische formules, platte structuurformule, Couper structuurformule, drievoudige binding, gas stikstof, elektronische formule, Lewis-formule, molecuulformule, enkele binding, dubbele binding, gas koolzuur.