Hybridisatie van sp-type koolstof2 het komt voor wanneer het een dubbele binding en twee enkele bindingen of een pi-binding (π) en drie sigma-bindingen (σ) heeft. In feite is sp-hybridisatie2 het wordt tot stand gebracht tussen de atomen die de dubbele binding tot stand brengen.
Een voorbeeld van zo'n molecuul is formaldehyde (CH2O). Let op de structuur hieronder:
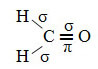
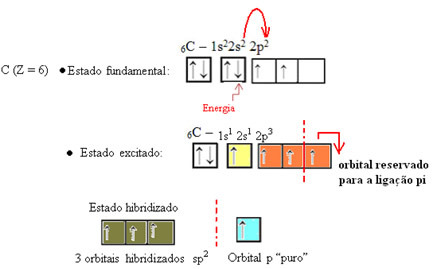
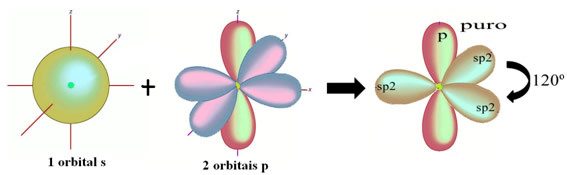
Zoals te zien in de tekst "sp type hybridisatie3", koolstofhybridisatie vindt plaats wanneer een elektron van subniveau 2s energie ontvangt en wordt "getransporteerd" naar de 2p subniveau en ontstaan dus 4 gehybridiseerde orbitalen uit de "mix" van atomaire orbitalen zuiver.
In het geval van formaldehyde weten we dat er een pi-binding zal zijn, dus een van deze gehybridiseerde orbitalen is gereserveerd voor deze binding, terwijl de andere drie de sigma-bindingen dragen:
Niet stoppen nu... Er is meer na de reclame ;)
De waterstofatomen die de enkele binding met koolstof maken, maken het met hun s-orbitaal:
De resterende "pure" p-orbitale dubbele bindingen met het zuurstofatoom en het formaldehydemolecuul heeft de volgende structuur:
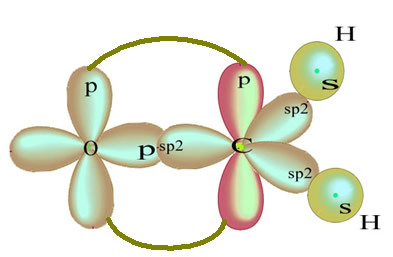
Wat betreft het type bindingen dat in deze formaldehydestructuur bestaat, hebben we:

Verbindingen: 1 = 2 = σs-sp2
3 = σp-sp2
4 =πp-p
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
FOGAÇA, Jennifer Rocha Vargas. "Sp2-type hybridisatie"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp2.htm. Betreden op 28 juni 2021.