Accu het is een systeem waarin chemische energie spontaan wordt omgezet in elektrische energie.
In 1836 bouwde de Engelse chemicus en meteoroloog John Frederic Daniell (1790-1845) een andere paal dan de destijds bekende paal: de paal van Alessandro Volta. In deze stapel he onderling verbonden twee elektroden, dit waren systemen bestaande uit een metaal ondergedompeld in een waterige oplossing van een zout gevormd door de kationen van dit metaal.
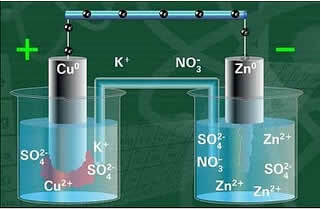
Een van de elektroden, de koperelektrode, bestond uit een koperen plaat gedompeld in een oplossing van kopersulfaat (CuSO4). De andere elektrode was een zinkelektrode, bestaande uit een zinkplaat ondergedompeld in een zinksulfaat (ZnSO4) oplossing.
Deze twee elektroden waren met elkaar verbonden door een elektrisch circuit dat een lamp bevatte, want als het aan zou gaan, zou dit het ontstaan van een elektrische stroom aangeven.
Ook was er een zoutbrug tussen hen. Deze brug bestond uit een U-vormige glazen buis met daarin een geconcentreerde waterige oplossing van een goed oplosbaar zout, zoals bijvoorbeeld kaliumchloride (KCl(aq)). De uiteinden van de buis zijn bedekt met katoen of agar.
Hieronder hebben we de structuur van deze cel of elektrochemische cel, die bekend werd als de Daniell-cel. Onthoud dat elke elektrode een halve cel wordt genoemd.
Met het circuit gesloten, gaat de lamp aan en na enige tijd, de zinken plaat is gecorrodeerd en heeft zijn massa afgenomen, terwijl de koperen plaat het tegenovergestelde is, zijn massa neemt toe (zoals weergegeven in de onderstaande afbeelding). Er wordt ook opgemerkt dat er is een toename van de concentratie in mol/L van de Zn-ionen2+ en een afname van Cu-ionen2+.
Het stapelschema van Daniell.
Waarom gebeurt dit?
Niet stoppen nu... Er is meer na de reclame ;)
Laten we, om dit te begrijpen, kijken naar de reacties die bij elke elektrode afzonderlijk plaatsvinden.
In de zinkelektrode vindt de volgende evenwichtsreactie plaats:
Zn(en) ↔ Zn2+(hier) + 2 en-
Dit betekent dat metallisch zink (van de plaat) oxidatie ondergaat, dat wil zeggen, het doneert twee elektronen aan het zinkkation (uit de oplossing) en wordt Zn2+. Het tegenovergestelde komt ook voor, het zinkkation dat in de oplossing aanwezig is, ontvangt de twee elektronen die door het zink worden gedoneerd en wordt metallisch zink. Daarom is er een ononderbroken proces van oxidatie en reductie.
Hetzelfde geldt voor de koperelektrode, die de globale reactie in dynamisch evenwicht zal hebben: Cu(s) ↔ Cu2+(hier) + 2 en-
Daniell realiseerde zich dat als hij deze twee elektroden met elkaar zou verbinden, de meer reactieve elektron zijn elektronen zou doneren aan het minder reactieve kation in plaats van dit te doen met de kationen in zijn eigen oplossing. In dit geval is zink het meest reactief en ondergaat het oxidatie, waarbij elektronen aan koper worden gedoneerd, vandaar de afname van zijn massa. De elektrode die oxidatie ondergaat, is de negatieve pool, de anode genaamd. De koperelektrode is degene die reductie ondergaat, het koperkation ontvangt de twee elektronen van zink en wordt de kathode (positieve pool) genoemd.
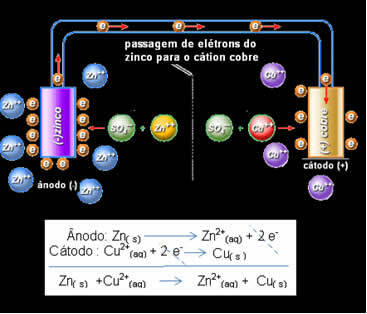
Elektronenpassage en Daniell's stack globale vergelijking.
Hierboven hebben we de globale vergelijking voor deze stapel, die wordt verkregen door de twee halfreacties op te tellen. De weergave of chemische notatie ervan wordt gemaakt volgens de volgende regel:

Dus voor Daniell's stack hebben we:
Zn / Zn2+// Kont2+ / ezel
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Brazilië School Team
Fysisch-chemisch - Chemie - Brazilië School
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
FOGAÇA, Jennifer Rocha Vargas. "Danill's stapel"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/quimica/pilha-daniell.htm. Betreden op 28 juni 2021.


