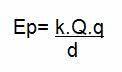DE clapeyron-vergelijking is een wiskundige uitdrukking die hoeveelheden relateert zoals druk (P), volume (V), temperatuur (T) en het aantal deeltjes (n) waaruit a. bestaat perfect of ideaal gas. Deze vergelijking is vernoemd naar de Franse natuurkundige Paulemileclapeyron en kan worden opgevat als een generalisatie van de empirische wetten van de gassenperfectinGay-Lussac, Charles en Boyle. Het was van fundamenteel belang voor de studie van ideale gassen en maakte de evolutie mogelijk van Thermische machines, waardoor ze de afgelopen decennia steeds efficiënter zijn geworden.
Zie ook: Natuurkundige ontdekkingen die per ongeluk zijn gebeurd
Clapeyron's vergelijking: ideale gaswet
De vergelijking van Clapeyron is afgeleid van drie empirische wetten, dat wil zeggen, wetten die werden bepaald op basis van experimenten. Dergelijke wetten verklaren het gedrag van gassen in gastransformatiesisovolumetrisch (Wet Gay-Lussac), isobaar (Charles wet) en isothermen (De wet van Boyle). Volgens deze wetten:
in de transformaties isovolumetrisch, de verhouding tussen druk en thermodynamische temperatuur van een ideaal gas blijft constant;
in de transformaties isobaar, de verhouding tussen het volume en de thermodynamische temperatuur van een ideaal gas is constant;
- in de transformaties isothermen, het product van druk en volume van een ideaal gas blijft constant.
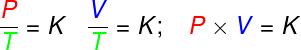
P – druk (Pa – pascal)
V – gasvolume (m³)
T – thermodynamische gastemperatuur (K – kelvin)
Uit de drie bovenstaande wetten bepaalt de Clapeyron-vergelijking wat de waarde hiervan is constante (K) verkregen in elk van de bovengenoemde transformaties. Volgens de vergelijking van Clapeyron is deze constante gelijk aan het aantal mol vermenigvuldigd met a constante R, bekend als de universele constante van ideale gassen, en gelijk aan Boltzmann-constante vermenigvuldigd met Het nummer van Avogadro.
Formule
Bekijk de formule die bekend staat als vergelijkinginClapeyron:
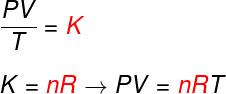
Nee – aantal mol (mol)
R – universele constante van ideale gassen (R = 0,082 atm.l/mol. K of 8,314 J.mol/K)
Als we de Clapeyron-vergelijking analyseren, is het mogelijk om te zien dat de druk uitgeoefend door ideale gassen is recht evenredig met temperatuur en ook om aantal mol. Verder, druk is omgekeerd evenredig met het volume bezet door aardgas.
Niet stoppen nu... Er is meer na de reclame ;)
O ideaal gasmodel mogelijk gemaakt door de Clapeyron-vergelijking wordt veel gebruikt voor de ontwikkeling van machines aangedreven door vloeistoffen, zoals stoommachines en verbrandingsmotoren.
Met de Clapeyron-vergelijking konden verschillende belangrijke resultaten worden verkregen. Een van hen voorspelt bijvoorbeeld dat 1 mol van een ideaal gas een volume van inneemt 22,4 l wanneer onderworpen aan de druk van 1 pinautomaat (1,01.105 Pa) en bij de temperatuur van 273K (0°C).
Zie ook: Belangrijkste concepten in de thermologie
Opgeloste oefeningen op de Clapeyron-vergelijking
Vraag 1 — (UECE) Een gas waarvan de temperatuur, het volume en de druk kunnen worden gerelateerd aan PV = nRT, heeft de volgende kenmerken:
a) zeer grote gemiddelde afstand tussen moleculen om intermoleculaire interacties buiten beschouwing te laten, behalve bij botsingen; moleculen ondergaan elastische botsingen.
b) zeer kleine gemiddelde afstand tussen moleculen; moleculen ondergaan inelastische botsingen.
c) zeer grote gemiddelde afstand tussen moleculen om intermoleculaire interacties buiten beschouwing te laten, behalve bij botsingen; moleculen ondergaan inelastische botsingen.
d) zeer grote gemiddelde afstand tussen moleculen en met sterke intermoleculaire interacties; moleculen ondergaan elastische botsingen.
Resolutie:
In het ideale gasmodel beweegt een groot aantal dimensieloze deeltjes met hoge snelheid in willekeurige richtingen. De enige interactie die deze deeltjes ondergaan zijn perfect elastische botsingen, dus het juiste alternatief is: letter A.
Vraag 2 —(UFRGS) Beschouw de volgende uitspraken over ideale gassen.
IK. De constante R aanwezig in de toestandsvergelijking voor gassen pV = nRT heeft dezelfde waarde voor alle ideale gassen.
II. Gelijke volumes van verschillende ideale gassen, bij dezelfde temperatuur en druk, bevatten hetzelfde aantal moleculen.
III. De gemiddelde kinetische energie van de moleculen van een ideaal gas is recht evenredig met de absolute temperatuur van het gas.
Welke zijn juist?
a) Alleen ik
b) Alleen II
c) Alleen III
d) Alleen I en II
e) I, II en III
Sjabloon:
Laten we eens kijken naar de alternatieven:
IK. correct, daarom wordt het de universele constante van ideale gassen genoemd.
II. correct. Volgens de vergelijking van Clapeyron, als twee ideale gassen dezelfde druk, temperatuur en volume hebben, dan is het aantal deeltjes in die gassen gelijk.
III. correct. Volgens de energie-equipartitiestelling is de kinetische energie van deeltjes in een ideaal gas evenredig met de temperatuur.
Daarom is het juiste alternatief de letter e.
Vraag 3 - (UFJF) Mannen als Clapeyron, Boyle, Mariotte, Gay-Lussac, van der Walls, onder anderen, hebben belangrijke studies ontwikkeld over de eigenschappen van gassen. Het gedrag van echte gassen benadert ideale gassen bij lage druk, evenals gassen in een groot volume en gassen die bij hoge temperaturen worden gehouden. Bedenk dat in een laboratoriumexperiment een container met volume V volledig gesloten is en 1 mol van een ideaal gas bevat onder een druk van 4,0 atm wordt onderworpen aan een uitzetting bij een constante temperatuur gelijk aan 127 º C en dat het gedrag van dit gas dat van een ideaal gas is, zoals getoond in grafisch.
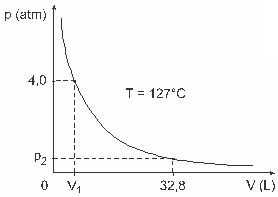
In dit geval, wanneer het gas een volume inneemt dat gelijk is aan 32,8 L, zal de door het gas uitgeoefende druk zijn:
(Gegeven: de universele constante van perfecte gassen is R = 0,082 atm. l/mol. K.)
a) 0,32 atm
b) 0,40 atm
c) 1,0 atm
d) 2,0 atm
e) 2,6 atm
Resolutie:
Brief C.
Om de oefening op te lossen, moeten we de gegevens toepassen op de Clapeyron-vergelijking, maar daarvoor moeten we de temperatuur, die in graden Celsius is, omzetten in kelvin. Uitchecken:

Door Rafael Hellerbock
Natuurkunde leraar