metalen zijn elementen die worden gekenmerkt door helderheid, sterkte, thermische en elektrische geleidbaarheid. Zij zijn toepasbaar in vrijwel alle industriële processen, aanwezig zijn in metaallegeringen die worden gebruikt bij de vervaardiging van gereedschappen, juwelen en munten en in chemische processen zoals redox, die verantwoordelijk zijn voor de werking van stapels en batterijen.
In het periodiek systeem zijn ze ingedeeld in:
halfmetalen
overgangsmetalen
alkalimetalen
aardalkalimetalen
In de staalindustrie worden ze onderverdeeld in:
ferro metalen
non-ferro metalen
zware metalen
Lees ook: Wat zijn de nieuwe elementen van het periodiek systeem?
Metalen kenmerken:

Ze zijn voor het grootste deel uitstekende geleiders van warmte en elektriciteit.
Ze hebben een glanzende uitstraling.
hoog hebben dichtheid.
Het zijn elektropositieve elementen (ze hebben de neiging om kationen te vormen - positieve ladingen).
Met uitzondering van de Kwik, het zijn elementen met een hoog smeltpunt en vast bij kamertemperatuur.
Ze hebben mechanische sterkte (taaiheid).
Ze zijn kneedbaar (kunnen worden gevormd zonder te breken).
Niet stoppen nu... Er is meer na de reclame ;)
Periodiek systeem metalen
alkalimetalen
Zijn de elementen van? eerste kolom van het periodiek systeem, familie 1A. Ze worden alkalimetalen genoemd omdat ze, wanneer ze met water worden gemengd, hydroxiden vormen, dat wil zeggen een alkalische (basische) oplossing.
U elementen die tot deze groep behoren zijn:
Lithium (li)
Natrium (Bij)
Kalium (K)
Rubidium (Rb)
Cesium (Cs)
Francium (Fr)
De elektronische configuratie van alkalimetalen in neutrale (ongeladen/geïoniseerde) toestand presenteert alleen: een elektron in de laatste schil (valentie laag). O atoomstraal en de reactiviteit van deze metalen neemt van boven naar beneden toe (waarbij de Periodiek systeem). Ze hebben een laag smeltpunt in vergelijking met andere metalen, zijn kneedbaar en niet erg dicht, hebben een mat aspect door de hoog oxidatiepotentieel.
Zie ook:Wat zijn de eigenschappen van materie?
aardalkalimetalen
Dit zijn elementen die voorkomen in de tweede kolom van het periodiek systeem, familie 2A. worden genoemd Alkalische aarde door de neiging om oplossingen te vormen met een basisch (alkalisch) karakter, en door aarde omdat voor de 19e eeuw de oxiden die door deze stoffen werden gevormd zo werden aangeduid. Deze term werd gebruikt om niet-onoplosbare metalen aan te duiden die geen mutatie ondergingen bij verhitting, gemeenschappelijke kenmerken van groep 2-elementen. Later, in het licht van nieuw onderzoek en experimenten, werd ontdekt dat de "aarde" -elementen in feite oxiden waren die door metalen werden gevormd.
Het zijn kneedbare metalen, met een lage dichtheid, hebben twee elektronen in de buitenste schil, worden gevonden, onder normale omstandigheden van temperatuur en druk, in vaste toestand. Behoor tot deze groep:
Beryllium (Worden)
Magnesium (Mg)
Calcium (Hier)
Strontium (dhr.)
Barium (Ba)
Radio (Kikker)
overgangsmetalen
verzin de groep B van het periodiek systeem, en bevinden zich tussen de aardalkalimetalen en de ametalen. Ze werden door IUPAC gedefinieerd als elementen met een onvolledige energetische onderlaag van energetica. De voorwaarde "overgangsmetalen" verwijst naar overgang van groep 2 naar 13 in het periodiek systeem en de toenemende toevoeging van elektronen in de 'd'-orbitaal.
De overgangsmetaalgroep bestaat uit dichte elementen, met hoge smelt- en kookpunten, en minder reactief dan groep 1 en 2 metalen (Familie 1A en 2A). Tot de overgangsmetalen behoren wolfraam, het element met het hoogste smeltpunt (3422 °C), en kwik (Hg), dat is een metaal dat onder normale omstandigheden van temperatuur en druk vloeibaar is, het smeltpunt is (-38,83 ° C).
Overgangsmetalen hebben verschillende oxidatietoestanden (NOX variabel) en vormen gekleurde stoffen.

Interne overgangselementen
Interne overgangselementen zij zijn:
Lanthaniden: reeks samengesteld uit elementen die 57 tot 71 protonen hebben en die, met uitzondering van promethium, natuurlijk zijn.
Actiniden: groep gevormd door de elementen variërend van 89 tot 103 in atoomnummer en die voor het grootste deel synthetisch zijn. Al deze groep zijn radioactief met korte halfwaardetijd.
De elementen van deze twee groepen hebben een hoog smeltpunt en zijn allemaal vast bij kamertemperatuur.
Halfmetalen
U halfmetalen er zijn in totaal zeven elementen:
Borium (B)
Silicium (Si)
Germanium (Ge)
Arseen (als)
antimoon (ma)
Telluur (Te)
Polonium (Po)
Deze classificatie wordt gegeven aan elementen die: fysisch-chemische kenmerken die relevant zijn voor metalen en ook andere die relevant zijn voor niet-metalen elementen. Halfmetalen hebben een glans, zijn brosse verbindingen, kunnen kationen en ook anionen vormen (afhankelijk van de toestand) en zijn tussengeleiders.
Soorten metalen
ferro: stoffen die ijzer in hun samenstelling bevatten. Zij zijn metaallegeringen die ijzer als een gemeenschappelijk element bevatten, maar kunnen worden geformuleerd met verschillende concentraties van koolstof, bijvoorbeeld, of gesmeed met verschillende technieken, dus producten met verschillende fysieke eigenschappen.
Non-ferro: legeringen gevormd door andere soorten metalen, zoals aluminium, koper, nikkel, zink, titanium.
Zware metalen: lood, nikkel, zink, kwik. Het zijn reactieve, giftige en bioaccumulerende metalen. Ze worden onder andere gebruikt in batterijen, lampen, munitie voor oorlogsartefacten.
Chemische bindingen van metalen
Metalen zijn elementen elektropositief, dat wil zeggen, ze hebben de neiging om elektronen te verliezen in een chemische binding. Wanneer een metaal interageert met een niet-metaal, een ionbinding uitvoeren vanwege het verschil in elektronegativiteit. De andere bindingsmogelijkheid voor metalen zijn metaalbindingen.
Bij metalen verbindingen optreden tussen metalen, met gedeeltelijke afgifte van elektronen en de vorming van een wolk of zee van elektronen rond de atomen, waardoor de metalen delen de eigenschappen van geleidbaarheid elektrisch en kneedbaar.
Zie ook: Geleiders en isolatoren - wat zijn de verschillen?
Het verkrijgen van metalen
De meeste metalen komen van nature voor in gesteenten en mineralen geassocieerd met andere elementen. Er zijn verschillende technieken om metalen te raffineren, zoals door middel van elektrolyse en chemische reacties om verbindingen te scheiden.
In het geval van metalen zijn de twee meest gebruikte technieken op industriële schaal om een bepaalde mate van zuiverheid in een metaal te verkrijgen: verschil van dichtheid en magnetische gevoeligheid (neiging dat het metaal moet reageren op een magnetisch veld).

opgeloste oefeningen
Vraag 1 - (Enem) Cadmium, aanwezig in batterijen, kan de grond bereiken wanneer deze materialen op onregelmatige wijze in het milieu terechtkomen of wanneer ze worden verbrand. In tegenstelling tot de metallische vorm zijn Cd2+-ionen extreem gevaarlijk voor het lichaam, omdat ze kunnen vervangen Ca2+-ionen, die een degeneratieve ziekte in de botten veroorzaken, waardoor ze zeer poreus worden en ernstige pijn in de botten veroorzaken. gewrichten. Ze kunnen ook enzymen remmen die worden geactiveerd door het Zn2+-kation, die uiterst belangrijk zijn voor het functioneren van de nieren. De figuur toont de variatie in de straal van sommige metalen en hun respectieve kationen.
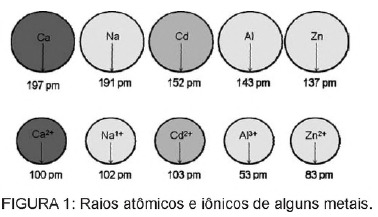
Op basis van de tekst is de toxiciteit van cadmium in zijn ionische vorm een gevolg van dit element
A) hebben een lage ionisatie-energie, wat de vorming van het ion bevordert en de binding aan andere verbindingen vergemakkelijkt.
B) hebben de neiging om te werken in biologische processen die worden gemedieerd door metallische kationen met ladingen variërend van +1 tot +3.
C) hebben een straal en lading die relatief dicht bij metaalionen ligt die inwerken op biologische processen en interferentie veroorzaken in deze processen.
D) hebben een grote ionische straal, waardoor het kan interfereren met biologische processen waaraan normaal kleinere ionen deelnemen.
E) een +2-lading hebben, waardoor het kan interfereren met biologische processen waaraan normaal gesproken ionen met lagere ladingen deelnemen.
Resolutie
alternatief C. Cadmium is een element dat lijkt op de metaalionen die we van nature in het lichaam hebben. Behalve dat het bioaccumulerend is, kan cadmium, dat vergelijkbaar is met metaalgroepen, binden aan sulfhydrylgroepen van moleculen eiwit, waardoor veranderingen optreden in biologische processen, zoals ontkalking, en vernietiging van weefsel en rode bloedcellen blood bloed.
Vraag 2 - Kruis bij kenmerken die relevant zijn voor metalen het verkeerde alternatief aan.
A) De meeste metalen zijn goede elektrische en thermische geleiders.
B) Sommige metalen zijn gevoelig voor oxidatie en/of reductie.
C) IJzer is een resistent en kneedbaar metaal, dat wil zeggen dat het gemakkelijk te vormen is.
D) Aardalkalimetalen hebben de naam "aarde" die verwijst naar de oxiden van deze metalen, die donker van kleur zijn.
E) Metalen zijn elementen van verschillende kleuren en dof door de werking van oxidatie.
Resolutie
Alternatief E. Metalen zijn van nature glanzend en metaalachtig van kleur, ze kunnen oxidatie ondergaan, wat veranderingen veroorzaakt in de kenmerken die relevant zijn voor de aspect van het onderdeel, maar dit is niet een fenomeen dat in alle metalen voorkomt, en in sommige gevallen hangt oxidatie af van verschillende factoren extern.
door Laysa Bernardes
Scheikundeleraar