Accu is een apparaat waarin een elektrische stroom wordt geproduceerd uit chemische energie afkomstig van een oxidatiereductie reactiere, dat wil zeggen, een soort van de reactant verliest elektronen (oxidatie), terwijl een andere soort elektronen wint (reductie).
Zie voorstellingen van de oxidatie- en reductiereacties die in elke stapel voorkomen:
Oxidatie: X → en + X+
Soort X verliest een elektron en verandert in een kation.
Vermindering: Y- + en → Y
het Y anion- krijgt elektron en transformeert in een neutrale Y-soort.
Basiscomponenten van een stapel
De basiscomponenten van een stapel zijn:
Anode: negatieve elektrode waarin de oxidatiereactie plaatsvindt, dat wil zeggen verlies van elektronen;
Kathode: positieve elektrode waarin de reductiereactie plaatsvindt, dat wil zeggen elektronenversterking;
Elektrolytische oplossing (zoutbrug) of een geleidend materiaal (zoals een grafietstaaf): is het middel waarmee door de anode opgegeven elektronen de kathode bereiken.
Basisprincipes van hoe een batterij werkt
Het functioneren van een stapel vindt plaats vanuit de volgende gebeurtenissen:
1e Principe: anode oxidatie:
Het metaal in de anode, omdat het een grotere neiging heeft om elektronen te verliezen, wordt een kation, zoals we in de onderstaande vergelijking hebben waargenomen:
Zn → Zn2+ + 2 en
2e Principe: kathodereductie
De kationen die deel uitmaken van het materiaal dat aanwezig is in de kathode (we gebruiken koper als voorbeeld), bij ontvangst de elektronen van de anode transformeren in metallisch koper, zoals we kunnen zien in de vergelijking balg:
kont2+ + 2e → Cu
eerste stapels
a) De batterij van Alessandro Volta
De stapelrug van Alessandro (de eerste stapel in de geschiedenis), geassembleerd in 1800, werd gevormd door geïntercaleerde metalen schijven, zoals in de onderstaande afbeelding:

Montage vergelijkbaar met Alessandro's Terug naar je stapel
De schijven waren doorschoten omdat ze een verschillende samenstelling hadden. De ene was gemaakt van zinkmetaal en de andere was gemaakt van koper, altijd gescheiden door katoen gedrenkt in pekel (een oplossing gevormd door water en zout).
B) De stapel van Daniell
Daniell's stapel, geassembleerd in 1836, bestond uit twee halve cellen verbonden door een geleidende draad en een zoutbrug.
Halfcel 1: het was de anode, dat wil zeggen, de negatieve pool van de batterij.
Het was samengesteld uit een zinkplaat en een deel van deze plaat was ondergedompeld in een oplossing gevormd door water en zinksulfaat (ZnSO4).
Halve cel 2: het was de kathode, dat wil zeggen de positieve pool van de batterij.
Het was samengesteld uit een koperen plaat en een deel van deze plaat was ondergedompeld in een oplossing gevormd door water en kopersulfaat (CuSO4).
zoutbrug
U-vormige buis die een oplossing bevatte gevormd door water en kaliumchloride (KCl), die de twee halve cellen (zink en koper) verbond en aan beide uiteinden een glaswol had.
batterijen momenteel
Momenteel zijn er verschillende stapelmodellen, maar over het algemeen zien ze er als volgt uit:
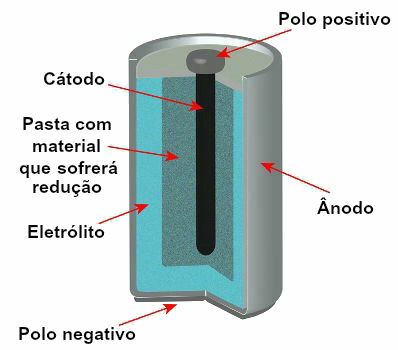
Schematische weergave van het model van een huidige stapel
De meest gebruikte modellen zijn de zogenaamde Leclanché batterij en de alkaline batterij, die de volgende verschillen hebben:
De) Leclanche stapel
Het heeft een anode gevormd door metallisch zink;
Het heeft een kathode gevormd door een pasta met ammoniumchloride, water, zetmeel en mangaandioxide;
Het heeft een grafietstaaf die dient als geleider voor de elektronen die van de kathode naar de anode vertrekken.
B) Alkaline batterij
Het heeft een anode gevormd door metallisch zink of cadmium;
Het heeft een kathode gevormd door kwikoxide, nikkeloxide en jodium;
Het moet een gemengde basis hebben in het materiaal waaruit de kathode bestaat.
Door mij Diogo Lopes Dias
Bron: Brazilië School - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-pilha.htm
