Enzymen zijn biologische katalysatoren die verantwoordelijk zijn voor het verhogen van de snelheid van een bepaalde chemische reactie. Enzymen zijn meestal eiwitten, maar er zijn er enkele ribonucleïnezuren die als enzymen werken, ribozymen genoemd.
Om een reactie te versnellen, moeten enzymen binden aan reagentia, die bekend staan als substraten. Lange tijd werd aangenomen dat deze verbinding op een zeer rigide manier plaatsvond, een patroon dat bekend staat als het sleutelslot. momenteel, Echter, het model dat bekend staat als geïnduceerde aanpassing wordt geaccepteerd., wat ervan uitgaat dat er kleine veranderingen optreden in de vorm van het enzym wanneer het substraat de actieve plaats binnengaat.
Lees ook: Wat is metabolisme?
Wat zijn enzymen?
Enzymen zijn biomoleculen die werken als katalysatoren, dat wil zeggen, ze zijn stoffen die de snelheid van chemische reacties die in levende wezens voorkomen zonder tijdens deze reacties te worden geconsumeerd. Zonder de werking van enzymen zouden sommige reacties erg traag verlopen, wat de stofwisseling zou schaden. Enzymen versnellen selectief reacties en zijn daarom zeer specifieke katalysatoren.
Enzymen kunnen een reactie versnellen door de activeringsenergie te verlagen, dat wil zeggen, ze verminderen de hoeveelheid energie die moet worden toegevoegd om een reactie te laten beginnen.
[publication_omnia]
Is elk enzym een eiwit?
Hoewel ze vaak worden gedefinieerd als biologische katalysatoren met een eiwitkarakter, niet elk enzym is een eiwit. Er zijn enkele RNA's die functioneren als enzymen, ribozymen genaamd. De meeste enzymen zijn echter eiwitten en worden daarom gevormd door aminozuren. De aminozuursamenstelling van deze biomoleculen bepaalt de driedimensionale structuur die het zal krijgen.
Lees ook: Hoe werken katalysatorstoffen?
Enzym-substraatcomplex
Het wordt het reagenssubstraat genoemd waarop een enzym inwerkt. Wanneer een enzym aan zijn substraat bindt, vormt het complex enzym-substraat. Deze binding vindt plaats in een specifieke regio, de actieve plaats genoemd.
Als we het hebben over op eiwitten gebaseerde enzymen, komt de actieve plaats overeen met slechts een paar aminozuren, waarbij de rest van het molecuul verantwoordelijk is voor het bepalen van de configuratie van de actieve plaats. De vorm van de actieve plaats en de vorm van het substraat zijn gerelateerd aan de specificiteit van het enzym, omdat ze complementair moeten zijn.
Model met sleutelvergrendeling
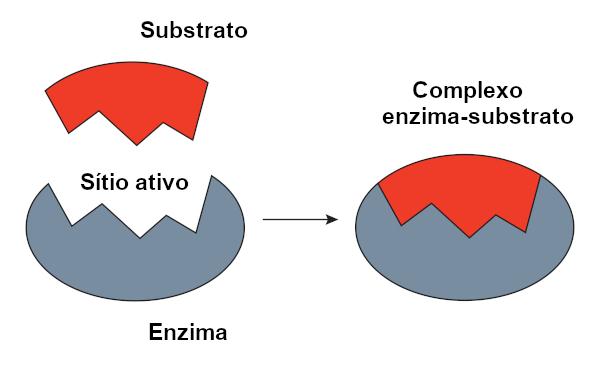
O key-lock-model, voorgesteld door Emil Fischer, wordt veel gebruikt om de interactie tussen enzym en substraat te verklaren. Volgens dit model is er een starre complementariteit tussen het enzym en het substraat, net als een sleutel en een slot. De actieve plaats van het enzym zou een complementaire vorm hebben met het substraat, wat perfect zou passen. Andere moleculen zouden daarom geen toegang hebben tot deze site, wat de specificiteit van het enzym zou garanderen. Net zoals een sleutel alleen een slot opent, zou een enzym zich alleen binden aan een substraat. Vandaag weten we echter dat dit model klopt niet, omdat enzymen geen starre structuren zijn zoals eerder werd gedacht.
Geïnduceerd passend model
Momenteel is de meest geaccepteerde model om het verband tussen een enzym en zijn substraat te verklaren is die van snap geïnduceerd, aanvankelijk voorgesteld door Koshland et al. De actieve site en het substraat werken niet star zoals een sleutel en slot. Onderzoek toont aan dat wanneer het substraat de actieve plaats binnengaat, het enzym een kleine wijziging ondergaat, wat de pasvorm tussen de actieve plaats en het substraat bevordert. Om dit model beter te begrijpen, kunnen we de enzym- en substraatinteractie zien als een handdruk, die na het eerste contact steviger wordt.
Cofactoren
De meeste enzymen hebben hulpmoleculen nodig om hun katalytische werking uit te voeren, de zogenaamde cofactoren. Cofactoren kunnen permanent aan het enzym worden gehecht of kunnen zwak en reversibel aan het substraat worden gehecht. Zij ook kan anorganisch of organisch zijn. Wanneer cofactoren organische moleculen zijn, worden ze genoemd co-enzymen.
Sommige vitamines fungeren als co-enzymen, dit is bijvoorbeeld het geval voor riboflavine, ook wel vitamine B2 genoemd. Als voorbeelden van anorganische cofactoren kunnen we ijzer en zink in hun ionische vorm noemen.
Lees ook: B-complexvitaminen - een groep vitamines die over het algemeen als co-enzymen werken
Enzym classificatie
Enzymen kunnen worden ingedeeld in: zes groepen, met als criterium het type reactie dat ze katalyseren.
Oxidoreductasen: enzymen die verband houden met de reacties van oxirvermindering.
Transferasen: katalyseren de overdracht van groepen van de ene verbinding naar de andere.
Hydrolasen: hydrolysereacties katalyseren.
Liases: handelen door groepen toe te voegen aan dubbele bindingen of groepen te verwijderen die een dubbele binding vormen.
Isomerasen: isomerisatiereacties katalyseren.
Links: enzymen die de afbraak van het molecuul van ATP, waarbij de energie die vrijkomt bij deze reactie wordt gebruikt om nieuwe verbindingen te vormen.
Niet stoppen nu... Er is meer na de reclame ;)
Factoren die de enzymactiviteit reguleren
De activiteit van een enzym wordt beïnvloed door factoren, met als belangrijkste de temperatuur en de pH. Temperatuur speelt over het algemeen een positieve rol bij chemische reacties, waardoor de snelheid van een enzymatische reactie toeneemt. Echter, wanneer de temperatuur- boven de optimale omstandigheden stijgt, daalt de reactiesnelheid aanzienlijk. Dit komt omdat de denaturatie van eiwitten wordt waargenomen. De meeste menselijke enzymen hebben een optimale temperatuur tussen 35 en 40 °C. Naast de temperatuur, pH het beïnvloedt ook de enzymatische activiteit en er is ook een optimale waarde. Voor de meeste enzymen ligt de optimale pH-waarde tussen 6 en 8.
Door Vanessa Sardinha dos Santos
Docent biologie

