Bij intermoleculaire krachten zijn een onderwerp in scheikunde dat zeker kan voorkomen in het National High School Exam (En ook). Daarom is het de moeite waard om de belangrijkste inhoud van dit onderwerp in dit artikel te bekijken.
Definitie
intermoleculaire krachten het zijn krachten - van verschillende intensiteiten (zwak, gemiddeld of sterk) - van elektrostatische aantrekking of bindingen die tot stand worden gebracht tussen de moleculen van een stof die de unie tussen hen in stand houden.
Soorten intermoleculaire krachten
De) geïnduceerde dipool
En de intermoleculaire kracht die optreedt tussen moleculen van een stof met een niet-polaire eigenschap. Het gebeurt bijvoorbeeld tussen moleculen van stoffen zoals O2, H2, Nee2, CO2, CH4.
De vereniging tussen deze moleculen vindt plaats wanneer er een dipool tussen wordt gecreëerd. Dit gebeurt wanneer de elektronen van het ene molecuul de elektronen van het andere verdringen, waardoor een negatieve en een positieve pool ontstaat, die van het ene molecuul naar het andere wordt overgedragen.
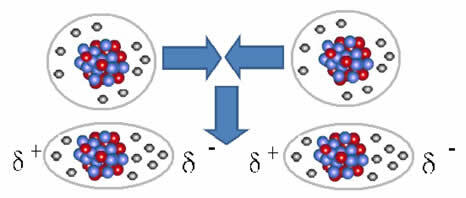
Weergave van dipoolvorming in niet-polaire moleculen
Tussen deze moleculen werden twee polen gevormd, en de negatieve pool van de ene interageert met de positieve pool van de andere. Omdat deze polen zijn gemaakt, is het een intermoleculaire kracht van lage intensiteit.
B) permanente dipool
En de intermoleculaire kracht die optreedt tussen moleculen van een stof met een polair kenmerk. Voorbeelden zijn moleculen van stoffen zoals HCN, H2O, NH3, CO, CH3kl.
De vereniging tussen deze moleculen vindt plaats wanneer de negatieve pool van de ene interageert met de positieve pool van de andere.
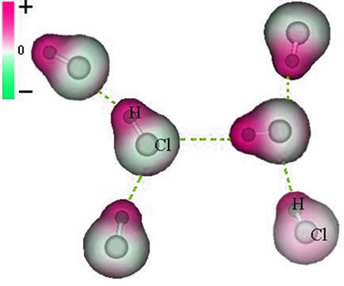
Weergave van de permanente dipoolkracht tussen HCl-moleculen
Omdat de polen al bestaan, is de intermoleculaire kracht van de permanente dipool sterker dan de geïnduceerde dipool.
ç) waterstofbruggen
Dat intermoleculaire kracht het komt voor tussen polaire moleculen die een waterstofatoom hebben dat direct is gebonden aan een zuurstof-, stikstof- of fluoratoom.
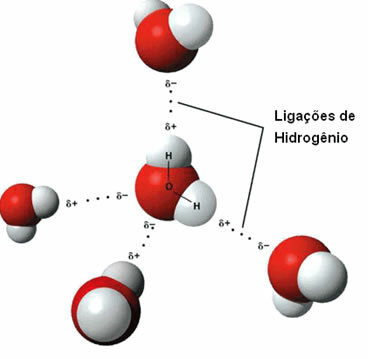
Weergave van waterstofbruggen tussen watermoleculen
Een waterstofbinding wordt gevormd wanneer de waterstof in het ene molecuul interageert met de zuurstof, stikstof of fluor van het andere molecuul.
d) dipool-ion
Deze intermoleculaire kracht treedt op tussen een polair molecuul, dat een paar niet-bindende elektronen heeft, en een ion (kation of anion) in de oplossing.
Het watermolecuul heeft bijvoorbeeld twee paar niet-bindende elektronen in zuurstof. Als er ionen in het waterige medium zitten, komen ze dichter bij het watermolecuul, omdat er polen in zitten.
Niet stoppen nu... Er is meer na de reclame ;)
Belang
Het belang van het kennen van de intermoleculaire krachten voor Enem het is het begrip dat ze brengen met betrekking tot de fysieke toestanden, het smeltpunt, het kookpunt en de oplosbaarheid van stoffen.
De) Relatie met het smelt- en kookpunt van de stof
Het smeltpunt geeft de temperatuur aan van de overgang van een vaste naar een vloeibare toestand, en het kookpunt geeft de temperatuur aan van de overgang van een vloeibare naar een gasvormige toestand.
Deze passage houdt rechtstreeks verband met de interactie tussen de moleculen van de stof, want wat de ene fysieke toestand van de andere onderscheidt, is het aggregatieniveau tussen de moleculen.
Dus hoe intenser de intermoleculaire kracht, hoe hoger het smelt- en kookpunt. Hoe minder intens de intermoleculaire kracht, hoe lager het smelt- en kookpunt. We kunnen dus de dalende volgorde van smelt- en kookpunt definiëren:
Waterstofbinding > permanente dipool > geïnduceerde dipool
B) Relatie tot oplosbaarheid
In het algemeen moeten we weten dat het gelijke het gelijke oplost, dat wil zeggen, de polaire stof lost de polaire stof op en de niet-polaire stof lost de niet-polaire stof op.
Er is echter nog steeds de mogelijkheid van interactie tussen de opgeloste moleculen en de oplosmiddelmoleculen. Dit gebeurt alleen als deze nieuwe interactie groter is dan wat er al bestaat tussen de moleculen van de stof zelf.
Voorbeeld van toepassing van intermoleculaire kracht in Enem
1e voorbeeld: (Enem-2011) De menselijke huid krijgt, wanneer ze goed gehydrateerd is, een goede elasticiteit en een zacht en glad uiterlijk. Aan de andere kant, wanneer het droog is, verliest het zijn elasticiteit en ziet het er ondoorzichtig en ruw uit. Om een droge huid te voorkomen, is het noodzakelijk om waar mogelijk vochtinbrengende crèmes te gebruiken, meestal gemaakt van glycerine en polyethyleenglycol:

De waterretentie op het huidoppervlak die wordt bevorderd door vochtinbrengende crèmes is een gevolg van de interactie van de hydroxylgroepen van de bevochtigingsmiddelen met het vocht in de omgeving door:
a) ionische bindingen
b) Londense troepen
c) covalente bindingen
d) dipool-dipoolkrachten
e) waterstofbruggen
Het antwoord op deze vraag is waterstofbinding, omdat het watermolecuul waterstof heeft gebonden aan een zuurstofatoom. Hetzelfde gebeurt met de moleculen van propyleenglycol en polyethyleenglycol, een gunstige voorwaarde voor het optreden van dit soort intermoleculaire kracht.
Door mij Diogo Lopes Dias
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
DAGEN, Diogo Lopes. "Intermoleculaire krachten in Enem"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/quimica/forca-intermoleculares-no-enem.htm. Betreden op 27 juni 2021.


