De organische groep alcoholen is algemeen bekend in de organische chemie en wordt gekenmerkt door de aanwezigheid van een hydroxyl (OH) gebonden aan een verzadigde koolstof. Er zijn alcoholen die onverzadigd zijn, zoals de onderstaande but-3-en-1-ol:
H2C ═ CH ─ CH2 CH2 oh
Sommige verbindingen hebben echter de hydroxyl direct gebonden aan een koolstof met een dubbele binding. Dit type verbinding is geen alcohol, het behoort tot de organische functie genaamd: enol.
Enols worden daarom gekenmerkt door de volgende functionele groep:
│
─ C ═ CH oh
De nomenclatuur van enols is gemaakt volgens het volgende schema:
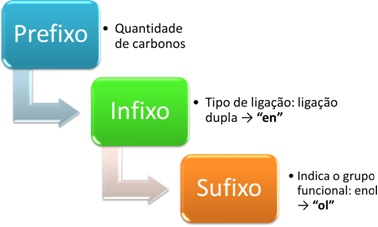
Beschouw bijvoorbeeld de volgende eenvoudigere enol:
H2C CH oh
Voorvoegsel: heeft 2 koolstofatomen: et
Tussenvoegsel: dubbele binding: en → ethyleen
Achtervoegsel: enol: Hallo
In het geval van ethenol was het niet nodig om de locatie van de functionele groep of onverzadiging te nummeren omdat er geen andere mogelijkheid was. Maar in de onderstaande gevallen is het noodzakelijk:
H3C─ CH═CH ─ OH: prop-1-en-1-ol
H3C─C═CH2: prop-1-en-2-ol
│
Oh
H3C─ CH═C CH2 CH3: pent-2-en-3-ol
│
Oh
H3C─C═CH CH3: but-2-en-2-ol
│
Oh
Enolen zijn zeer onstabiele verbindingen, omdat ze een soort dynamische isomerie kunnen ondergaan, tautomerie genaamd, waarbij de isomeren in dynamisch evenwicht naast elkaar bestaan in dezelfde vloeibare fase.
Niet stoppen nu... Er is meer na de reclame ;)
De zuurstof in een enol is zeer elektronegatief, wat de elektronen aantrekt uit de dubbele binding van koolstof, een zwakke binding die gemakkelijk te verdringen is en een aldehyde of een keton vormt.
In een azijnzuuraldehydeoplossing (ethanal) wordt bijvoorbeeld een klein deel omgezet in ethenol, dat op zijn beurt weer regenereert tot aldehyde. Er is dus een chemisch evenwicht tussen deze verbindingen met dezelfde molecuulformule C2H4O:
Ethanal Ethanol
Oh
║ │
H3Ç - - H ↔ H2Ç ═ C — H
enol aldehyde
Een ander enol, prop-1-en-2-ol, kan in dynamisch evenwicht komen met een keton, propanon:
Propanon Prop-1-en-2-ol
OH OH
║ │ │
H3C — C — C — H ↔ H2Ç ═ C — CH2
enol keton
Lees voor meer details de tekst: Dynamisch constitutioneel isomerie of tautomerie.
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
FOGAÇA, Jennifer Rocha Vargas. "Enols en zijn nomenclatuur"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/quimica/enois-sua-nomenclatura.htm. Betreden op 27 juni 2021.
Chemie

Ga naar deze link en leer meer over de organische functie van fenolen, een groep zuurstofrijke stoffen, van: grote reactiviteit, waarvan de zuurgraad groter is dan die van alcoholen (verbindingen die ook een groep hebben) hydroxyl). De structuur onderscheidt zich door een hydroxidegroep (OH) die direct is gekoppeld aan een aromatische verbinding.
Belangrijkste fenolen, aspirine, picrinezuur, bakelieten, fenolftaleïne afstotende eigenschap van cresol, creoline, lysol, cresols, olie uit koolteer, vervaardiging van conserveermiddelen voor hout.
Chemie
Weet waar de verschillende soorten vlakke en ruimtelijke isomeren over gaan, zoals functie, positie, keten, tautomerie, metamerie, cis-trans geometrische en optische isomerie.
Chemie

Hydroxyl functionele groep, Primaire alcoholen, Secundaire alcoholen, Tertiaire alcoholen, Methanol, Glycerol, Ethanol, bereiding van nitroglycerine, vervaardiging van verven, productie van alcoholische dranken, azijnzuur, brandstof auto's.


