Energie oxidatie in alkynen is een organische reactie die optreedt wanneer een alkyn (een koolwaterstof met een drievoudige binding tussen twee koolstofatomen) wordt toegevoegd aan een zure oplossing met de reagens van baeyer (Kaliumpermanganaat - KMnO4).
OPMERKING: Een reactie van energie oxidatie kan worden uitgevoerd met kaliumdichromaat (K2Cr2O7), en niet alleen kaliumpermanganaat.
Wanneer een reactie van energetische oxidatie in alkynen wordt uitgevoerd, de producten die kunnen ontstaan zijn carbonzuren, water (het enige item dat in een van hen voorkomt) en koolstofdioxide (CO2).
Baeyer-reagens in zuur medium
Wanneer Baeyer's reagens wordt gemengd met water, in aanwezigheid van a zuur (stof die H-ionen kan afgeven+), de vorming van twee oxiden (kaliumoxide en mangaanoxide II) en ontluikende zuurstofatomen ([O]).

Mechanismen van energie-oxidatie in alkynen
1e mechanisme: het verbreken van de drievoudige binding.
Aanvankelijk wordt de drievoudige binding aangevallen door ontluikende zuurstofatomen gevormd door Baeyer's reagens. Deze aanval zorgt ervoor dat de drievoudige binding volledig wordt verbroken.
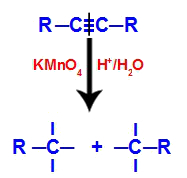
Verstoring van de drievoudige binding door de aanval van ontluikende zuurstofatomen
Wanneer de drievoudige binding wordt verbroken, wordt het alkyn in twee delen gesplitst. Op elk van de koolstofatomen die een drievoudige binding hadden, verschijnen drie vrije valenties.
2e mechanisme: Interactie van hydroxylgroepen
Elk van de vrije valenties op de koolstofatomen waar de drievoudige binding was, wordt ingenomen door hydroxylgroepen (OH), die een polyol vormen (alcohol met meerdere hydroxylen).
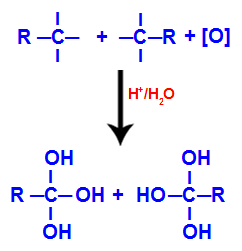
Vorming van polyol met hydroxylgroepen na splitsing van drievoudige binding
OPMERKING: Als de koolstof waar de drievoudige binding was, een waterstofatoom heeft, zal dat waterstofatoom een ontluikende zuurstof ontvangen en ook een andere hydroxyl vormen.
3e mechanisme: Vorming van watermoleculen
Wanneer een koolstof twee of meer OH-groepen heeft, wordt het een zeer onstabiele structuur door de aanwezigheid van extreem elektronegatieven. Dus als gevolg van instabiliteit ondergaat het molecuul zelf-uitdroging, dat wil zeggen, een hydroxyl bindt aan hydronium (H+) van een ander hydroxyl en vormt water.

Vorming van watermoleculen uit twee hydroxylen die aanwezig zijn in de gevormde polyol
Niet stoppen nu... Er is meer na de reclame ;)
4e mechanisme: Productvorming
Na de vorming van watermoleculen verliest de koolstof een binding door de uitgang van a hydroxyl, en de zuurstof van de andere hydroxyl verliest ook een binding die werd gemaakt met a waterstof. Daarom verschijnt tussen deze koolstof en zuurstof een dubbele binding, die een carbonyl (C=O) vormt en beide stabiliseert.
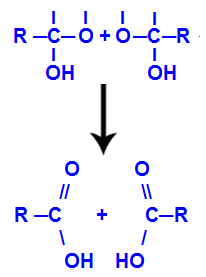
Carbonylvorming in de twee structuren verkregen uit alkyn
Voorbeeld van een alkyn-energie-oxidatievergelijking:
Voorbeeld: Energetische oxidatie van But-1-ino
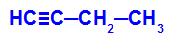
Structuurformule van but-1-yne
Wanneer but-1-yne in een medium wordt geplaatst dat Bayer's reagens, water en zuur bevat, breekt de binding. drievoudige bestaande tussen koolstofatomen 1 en 2, vanwege de aanval van de ontluikende zuurstofatomen die in het midden bestaan, zoals in de vergelijking balg:
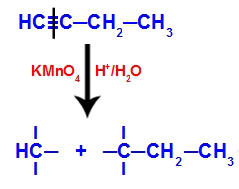
Verbreken van de but-1-yne verbindingen
Nadat de drievoudige binding is verbroken, krijgen koolstofatomen 1 en 2 drie hydroxylen, maar koolstof 1 heeft er nog een omdat het had een waterstofatoom (dat bindt aan een ontluikende zuurstof), waardoor twee polyolen werden gevormd (fragment 1 en 2).

Vergelijking die de vorming van polyolen weergeeft
Kort daarna, omdat polyolen onstabiel zijn, hebben we de vorming van watermoleculen uit de hydroxylen. In fragment 1 verschijnt een watermolecuul (omdat er drie hydroxylen zijn) en in fragment 2 verschijnen twee moleculen (omdat er vier hydroxylen zijn).
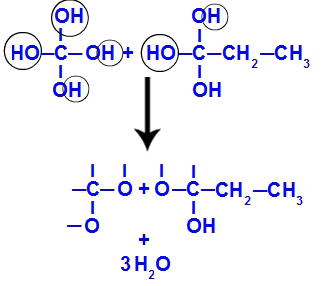
Vorming van watermoleculen uit but-1-yne fragmenten
Ten slotte hebben we de vorming van de dubbele binding tussen de koolstoffen die hydroxyl hebben verloren en de zuurstofatomen die waterstof hebben verloren, wat aanleiding geeft tot carbonylen.

Vorming van carbonylen in de but-1-yne fragmenten
Met de bovenstaande vergelijking kunnen we zien dat but-1-yne aanleiding gaf tot een carbonzuur en koolstofdioxide (CO2).
Door mij Diogo Lopes Dias
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
DAGEN, Diogo Lopes. "Energie-oxidatie in alkynen"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/quimica/oxidacao-energetica-alcinos.htm. Betreden op 28 juni 2021.
Alkynen, ethische koolwaterstoffen, acetylenische koolwaterstoffen, acyclische koolstofketen, koolstofketen homogene, onverzadigde koolstofketen, drievoudige binding, PVC, PVA, acetyleen, synthetische rubbers, kunststoffen, draden textiel.


