Halogenēšanas reakcijas ir organiskas aizvietošanas reakcijas veids, tas ir, tās, kurās a atomu vai atomu grupas aizstāj ar citas molekulas atomiem vai atomu grupām organiski.
Parasti šāda veida reakcija notiek ar alkāniem un aromātiskajiem ogļūdeņražiem (benzols un tā atvasinājumi).
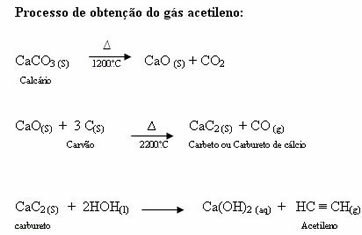
Halogenēšanu sauc par tāpēc, ka tā notiek ar vienkāršām halogēnu vielām: F2, Cl2, br2 Hei2. Tomēr visizplatītākais no tiem ir hlorēšana (Cl2) un bromēšana (Br2), jo fluors ir ļoti reaktīvs un tā reakcijas ir sprādzienbīstamas un grūti kontrolējamas, pat iznīcinot organiskās vielas:
CH4. punkta g) apakšpunkts + 2 F2. punkta g) apakšpunkts → Cs) + 4HFg)
Reakcijas ar jodu notiek ārkārtīgi lēni.
Tālāk ir minēti galvenie halogenēšanas veidi un daži piemēri:
1. Halogenēšana ar alkāniem: Tā kā alkāni ir slikti reaģējoši, to halogenēšanas reakcijas notiek tikai saules gaismas (λ), ultravioletās gaismas vai spēcīgas karsēšanas klātbūtnē. Šāda veida reakcija tiek veikta, lai iegūtu alkilhalogenīdu.
Piemērs: metāna monohlorēšana:

Šajā gadījumā tas notika no metāna ūdeņraža atoma (CH4) aizstāj ar hlora atomu, iegūstot monohlormetānu. Ja hlora būtu par daudz, šī reakcija varētu turpināties, aizstājot visus metāna ūdeņražus.
1.1. Halogenēšana alkānos ar vairāk nekā 3 oglekļiem: Ja reaģējamam alkānam ir vismaz 3 oglekļa atomi, mēs iegūstam dažādu aizvietotu savienojumu maisījumu. Skatiet metilbutāna monohlorēšanas piemēru zemāk:
Nepārtrauciet tūlīt... Pēc reklāmas ir vēl vairāk;)

Katra savienojuma daudzums būs proporcionāls šādai ūdeņraža izdalīšanās kārtai molekulā:

Tādējādi iepriekšminētajā gadījumā lielākais daudzums būs 2-metil-2-hlorbutāns un mazākais 2-metil-1-hlorbutāns.
2. Benzola halogenēšana: Benzols parasti nereaģē ar hloru vai bromu. Tomēr, ja kā katalizatoru izmanto Lewis skābi (parasti izmanto FeCl3, FeBr3 vai AlCl3, viss bezūdens formā), benzols viegli reaģē halogenēšanas reakcijā.
Hlorīdu un dzelzs bromīdu var iegūt, vienkārši pievienojot maisījumam dzelzi, un tādā veidā tas reaģē ar halogēnu un rada Lewis skābi:
2 Fe + 3 Br2 → 2 FeBr3
Skatīt benzola halogenēšanas piemēru un tā mehānismu:

3. Benzola atvasinājumu halogenēšana:Šādos gadījumos aizstāšanu vada aizvietotājs vai funkcionālā grupa, kas pievienota aromātiskajam kodolam. Lai uzzinātu, kā tas notiek, izlasiet tekstus "Stūres radikāļi benzola gredzenā" un "Meta un orto-to-direktoru radikāļu elektroniskie efekti”.
Autore Jennifer Fogaça
Beidzis ķīmiju
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
FOGAÇA, Jennifer Rocha Vargas. "Organiskās halogenēšanas reakcijas"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/reacoes-organicas-halogenacao.htm. Piekļuve 2021. gada 28. jūnijam.