sāls tilts ierosināja angļu ķīmiķis Frederiks Daniels 1836. gadā, kad šis zinātnieks izveidoja akumulatoru nosaukts viņa vārdā (Danila kaudze). šo tiltu ir U veida caurule, kurai ir divi poraini gali. (sastāv no kokvilnas vai agara-agara) un satur ūdens šķīdumu, ko veido ūdens un sāls. Tas netieši savieno divu šūnu šūnu (anoda un katoda) šķīdumus.
Novērošana: Anods ir akumulatora negatīvais pols, un tajā notiek oksidēšanās, katods ir pozitīvais pols un kur notiek reducēšanās.
Lai saprastu sāls tilta nozīmi, sākotnēji ir jāsaprot, kā darbojas kaudze. Skatiet zemāk redzamo diagrammu:
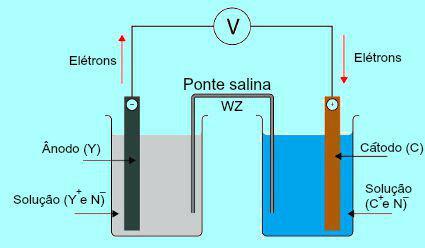
Daniela kaudzes vispārējā shēma
Sākotnēji anodā esošās plāksnes metāls (Y) tiek oksidēts. Veicot oksidēšanu, metāls pārvēršas par katjonu, kas iekrīt šķīdumā, kurā atrodas plāksne. Šī iemesla dēļ anoda šķīdumā sāk būt lielāka katjonu koncentrācija (Y+). Šajā gadījumā tiek novērota anoda metāla plāksnes samazināšanās.
Y → un- + Y+
Pēc tam anoda plāksnes metāla oksidēšanas laikā zaudētie elektroni pārvietojas pa ārējo elektrisko vadu un nonāk pie metāla plāksnes, kas atrodas katodā. Tādējādi plāksne, kas atrodas pie katoda, tiek uzlādēta ar elektroniem.
-
Pašreizējie katjoni (C.+) šķīdumā virzās uz katoda plāksni, jo tā ir uzlādēta ar elektroniem. Katijoni, iegūstot elektronā esošos elektronus, kļūst neitrāli (stabili un cieti) un tiem pielīp. Šī iemesla dēļ katoda šķīdumā ir lielāka anjonu koncentrācija nekā katjonos. Šajā gadījumā tiek novērots katoda metāla plāksnes izmēra pieaugums.
Nepārtrauciet tūlīt... Pēc reklāmas ir vēl vairāk;)
Ç+ + un- → C
No izpratnes par to, kā Daniela kaudze, ir iespējams novērot, ka anodā esošais šķīdums saņem lielāku daudzumu Y katjonu+ X plāksnes metāla oksidēšanās dēļ. Savukārt katodā esošais šķīdums zaudē katjonus (C.+), jo viņi cieš no plāksnes samazināšanās.
Tieši šajā jautājumā tiek uzsvērts sāls tilta darbs. Šī tilta galvenā funkcija ir veicināt lādiņu līdzsvaru gan anoda, gan katoda šķīdumos. Sāls tiltā mums vienmēr ir disociēta sāls (parasti kālija hlorīds vai amonija nitrāts.). Skatiet vienādojuma attēlojumu sāls tiltā:
WZ + H2O → R+ + Z-
Sāls tiltā ir divi joni (W+ un Z-), kas tiek novirzīti uz katodu un anodu saskaņā ar:
) Anods uztver anjonus (Z-), kas atrodas sāls tiltā elementa (Y) oksidēšanās dēļ, kas izraisa katjonu (Y+) šķīdumā.
B) Katods saņem katjonus (W+), jo akumulatora darbības laikā katijons (C.+), kas atrodas šķīdumā, tiek samazināta uz tāfeles. Tādējādi katoda šķīdumā ir lielāks anjonu daudzums (N-) un tāpēc saņem sāls tiltā esošo katjonu.
Autors: Diogo Lopes Dias
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
DIENAS, Diogo Lopes. "Buru tilts"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/ponte-salina.htm. Piekļuve 2021. gada 28. jūnijam.
