Akumulators ir ierīce, kurā elektrisko strāvu ražo no ķīmiskās enerģijas, kas nāk no a oksidoredukcijas reakcija, tas ir, viena reaģenta suga zaudē elektronus (oksidēšanās), bet cita suga iegūst elektronus (reducēšanās).
Skatīt oksidēšanās un reducēšanās reakciju attēlojumus, kas notiek jebkurā kaudzē:
Oksidēšana: X → un + X+
X suga zaudē elektronu un pārvēršas par katjonu.
Samazinājums: Jā- + un → Y
Y anjons- iegūst elektronu un pārveidojas par neitrālu Y sugu.
Kaudzes pamatkomponenti
Steka pamatkomponenti ir:
Anods: negatīvs elektrods, kurā notiek oksidēšanās reakcija, tas ir, elektronu zudums;
Katods: pozitīvs elektrods, kurā notiek reducēšanās reakcija, tas ir, elektronu pieaugums;
Elektrolītiskais šķīdums (sāls tilts) vai vadītspējīgs materiāls (piemēram, grafīta stienis): ir līdzeklis, ar kura palīdzību anoda atdotie elektroni sasniedz katodu.
Akumulatora darbības pamati
Steka darbība notiek no šādiem notikumiem:
1. princips: Anoda oksidēšana
Metāls anodā, tā kā tam ir lielāka tendence zaudēt elektronus, kļūst par katjonu, kā mēs novērojām zemāk esošajā vienādojumā:
Zn → Zn2+ + 2 un
2. princips: katoda samazināšana
Katijoni, kas ir katoda materiāla daļa (kā piemēru izmantosim varu), saņemot elektroni no anoda pārveidojas par metālisku varu, kā redzam vienādojumā zemāk:
Ass2+ + 2e → Cu
pirmās pāļi
a) Alesandro Volta akumulators
Alesandro pāļu aizmuguri (pirmo kaudzi vēsturē), kas tika samontēta 1800. gadā, veidoja interkalēti metāla diski, kā parādīts zemāk esošajā attēlā:

Montāža līdzīga Alesandro Atpakaļ pie jūsu kaudzes
Diski tika savīti, jo tiem bija atšķirīgs sastāvs. Viens bija izgatavots no cinka metāla, bet otrs - no vara, to vienmēr atdalīja ar sālījumā iemērcētu kokvilnu (šķīdumu, ko veido ūdens un sāls).
Nepārtrauciet tūlīt... Pēc reklāmas ir vēl vairāk;)
B) Daniela kaudze
Daniela kaudze, kas samontēta 1836. gadā, sastāvēja no divām pusšūnām, kuras savienoja vadoša stieple un sāls tilts.
Puse šūnas 1: tas bija anods, tas ir, akumulatora negatīvais pols.
Tas sastāvēja no cinka plāksnes, un daļa no šīs plāksnes tika iegremdēta ūdens un cinka sulfāta (ZnSO) veidotā šķīdumā.4).
2. šūna: tas bija katods, tas ir, akumulatora pozitīvais pols.
Tas sastāvēja no vara plāksnes, un šīs plāksnes daļa tika iegremdēta šķīdumā, ko veidoja ūdens un vara sulfāts (CuSO4).
sāls tilts
U veida caurule, kurā bija ūdens un kālija hlorīda (KCl) veidots šķīdums, kas savienoja abas pusšūnas (cinku un varu) un abos galos bija stikla vate.
baterijas
Pašlaik ir vairāki skursteņu modeļi, bet kopumā tie izskatās šādi:
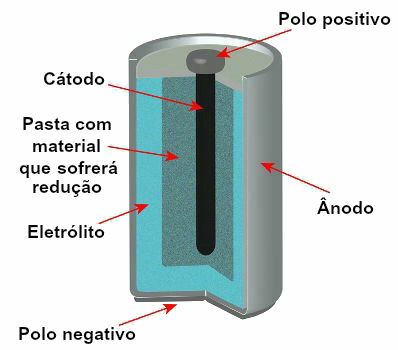
Shēma, kas attēlo pašreizējā kaudzes modeli
Visbiežāk izmantotie modeļi ir tā saucamais Leclanché akumulators un sārma akumulators, kuriem ir šādas atšķirības:
) Leklanšas kaudze
Tam ir anods, ko veido metāla cinks;
Tam ir katods, ko veido pastas ar amonija hlorīdu, ūdeni, cieti un mangāna dioksīdu;
Tam ir grafīta josla, kas kalpo kā vadītājs elektroniem, kas no katoda atiet anoda virzienā.
B) Sārma akumulators
Tam ir anods, ko veido metāla cinks vai kadmijs;
Tam ir katods, ko veido dzīvsudraba oksīds, niķeļa oksīds un jods;
Tam jābūt jauktai pamatnei materiālā, kas veido katodu.
Autors: Diogo Lopes Dias
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
DIENAS, Diogo Lopes. "Kas ir akumulators?"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-pilha.htm. Piekļuve 2021. gada 27. jūnijam.
