Idejas par matērijas (atoma) uzbūvi radās Senajā Grieķijā, ap 450. gadu pirms mūsu ēras. a. galvenokārt no Democrito un Leucipo. Tomēr atoms zinātnisko raksturu faktiski saņēma tikai pēc tā sauktā Daltona atomu teorija.
Daltona atomu teorija tas bija fundamentāls atomu zināšanu attīstībai, jo kalpoja par pamatu citiem zinātniekiem uzzināt atomu un tā īpašības.
Kurš bija Džons Daltons?
Džons Daltons, pēc apmācības ķīmiķis, dzimis Kambrijā, Anglijā, 1766. gadā un miris Mančestrā 1844. gadā. Kopš agras bērnības viņa dzīve bija paredzēta zinātniskiem pētījumiem un mācīšanai, tik daudz, ka viņš mācīja vai veicināja dažādu zināšanu jomu attīstību.
Viņa kā zinātnieka lielākais mantojums tomēr bija pirmās atomu teorijas izstrāde. Daltona atomu teorija 1808. gadā parādījās vairākos eksperimentos, kas saistīti ar gāzu sajaukumu un zināšanām par Lavoizjē piedāvātajiem darbiem.
Daltona atomu teorijas postulāti
Daltona atomu teorija balstījās uz eksperimentiem, taču neviens no šiem eksperimentiem nevarēja skaidri atklāt atomu. Tādējādi Daltons nosauca atomu par matērijas mazāko daļu.
Daltona teorija sniedz daudz vairāk postulātu nekā pierādījumu. Skatīt dažus no tiem:
Atomi ir masveida un sfēriskas formas (līdzīgi biljarda bumbai);
Atomi ir nedalāmi;
Atomi ir neiznīcināmi;
Viens ķīmiskais elements tas ir atomu kopums ar vienādām īpašībām (izmēru un masu);
Dažādu ķīmisko elementu atomiem ir atšķirīgas īpašības;
To diferencēšanai var izmantot divu atomu relatīvo svaru;
Savienojuma ķīmisko vielu veido viena un tā pati dažādu veidu atomu kombinācija;
Dažādas ķīmiskās vielas tiek veidotas, apvienojot dažādus atomus.
Daltonas atomu modeļa attēlojumi
Daltons nosauca savu atomu modeli par biljarda bumbu un tāpēc ar sfērisku simbolu palīdzību sāka attēlot savā laikā zināmo elementu atomus.
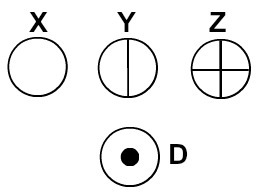
Atomi, kas attēloti saskaņā ar Daltona atomu teoriju
Katrs atomu attēlojums, kam ir noteikta detaļa, norāda atšķirīgu ķīmisko elementu. Didaktiski pamatskolas un vidējā līmeņa grāmatas un vingrinājumi atomus attēlo tikai ar sfērām ar dažādām krāsām.
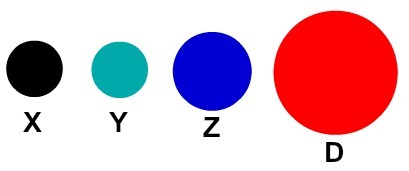
Didaktiskā atomu attēlošana
Daltona atomu teorijas ieguldījums
izpratne par Lavoizjē masu saglabāšanas likums
Franču ķīmiķis Lavoizjē 1785. gadā apgalvoja, ka Ķīmiskā reakcijā masa tiek saglabāta, jo nav ne atomu radīšanas, ne iznīcināšanas ”. Daltona atomu teorija pierādīja šo faktu, jo viens no viņa postulātiem apgalvo, ka atoms ir neiznīcināms.
Tādēļ, ja mēs veicam ogļu (C) sadedzināšanu skābekļa gāzes (O2), mums notiks ķīmiskā reakcija starp vienu oglekļa atomu un diviem skābekļa atomiem. Šīs reakcijas rezultātā veidosies oglekļa dioksīds (CO2), kurā ir tieši tie paši atomi, kas veidoja vielas pirms reakcijas.
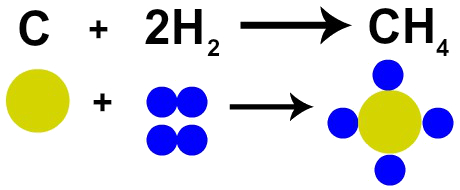
Lavoizjē likuma attēlojums ar Daltona atomu modeli
izpratne par vienkāršas vielas
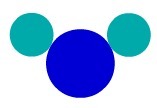
Izmantojot Daltona atomu modelis, mēs varam saprast vienkāršu vielu, tas ir, tādu, kurai ir tādas pašas īpašības atomi, kas veido molekulu. Tāpēc mums ir atomi, kas pieder pie tā paša ķīmiskā elementa.
F vielā2, piemēram, mums ir divi fluora atomi, tāpēc mums attēlojumā jāizmanto divu veidu vienādi atomi saskaņā ar Daltona atomu teoriju.

Vienkāršs vielas attēlojums saskaņā ar Daltona atomu modelis
izpratne par saliktas vielas
Saliktā vielā mums ir molekulas veidojoši dažādu īpašību atomi. Tāpēc mums ir dažādi ķīmiskie elementi, kas veido vielu.
H viela2Piemēram, O ir trīs atomi: divi ūdeņradis un viens skābeklis. Skatiet tā attēlojumu saskaņā ar Daltona atomu modeli:
Savienotas vielas attēlojums atbilstoši ādaiDaltona atomu modelis
Izpratne par maisījumiem
Maisījuma (divu vai vairāku dažādu vielu savienošanās) izpratne, izmantojot Daltona atomu teoriju, ir vienkārša: vienkārši ievietojiet divas dažādas molekulas vienā traukā.

Otrā maisījuma attēlojums Daltona atomu modelis
Citi Džona Daltona zinātniskie ieguldījumi
ieviesa jēdzienu atomu masa;
Formulēja gāzu daļējā spiediena likumu (Daltona likums);
Atklāja redzes traucējumus krāsu aklums;
Pētīja tvaiku un gāzu uzvedību dažādās temperatūrās;
Viņš atklāja, ka visas gāzes paplašinās (tās mēģina ieņemt noteiktu vietu) telpā vienādi.
Autors: Diogo Lopes Dias
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/teoria-atomica-dalton.htm
