Lai notiktu ķīmiska reakcija, ir jāievēro četri pamatnosacījumi, kas ir:
1. Reaģentiem ir jāsazinās;
2. Starp reaģentiem jābūt ķīmiskai afinitātei;
3. Reaģenta daļiņu sadursmēm jābūt efektīvām;
4. Aktivizācijas enerģija ir jāsasniedz.
Īsumā aplūkojiet katru gadījumu:
1.Reaģentu kontakts:
Šis nosacījums ir acīmredzams, jo pat tad, ja reaģentiem ir liela afinitāte vienam pret otru, tāpat kā skābju un bāzu gadījumā, ja tie ir atdalīti, reakcija nenotiks. Viņiem jāsaskaras, lai to daļiņas varētu sadurties, pārraujot reaģentu saites un veidojot produktu saites.

2.Ķīmiskā afinitāte:
Kā mēs redzējām, reaģentu kontakts ir nepieciešams, bet ne pietiekami. Piemēram, ja mēs nātriju nonāksim saskarē ar ūdeni, notiks ārkārtīgi vardarbīga reakcija, bet, ja mēs ievietosim zeltu, mēs neredzēsim nekādu atšķirību. Tas ir tāpēc, ka dažādām vielām ir atšķirīga ķīmiskā afinitāte viena ar otru, vai arī tām vispār nav afinitātes. Jo lielāka ir ķīmiskā afinitāte, jo ātrāk notiek reakcija.
Minētajos piemēros nātrijam ir liela afinitāte pret ūdeni, tik daudz, ka, lai nesaskartos ar gaisa mitrumu, metāliskais nātrijs tiek uzglabāts petrolejā. Savukārt zelts ir inerts, tāpēc zelta pieminekļi kalpo tik ilgi, kā Ēģiptes sarkofāgi.

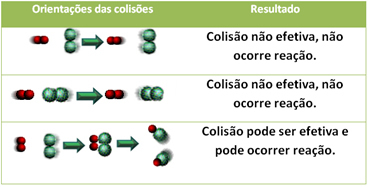
3.Sadursmju teorija:
Pat savienojumos, kuriem ir ķīmiska afinitāte, reakcijas norisei ir nepieciešams, lai to daļiņas, atomi vai molekulas efektīvi sadurtos. Ne visas daļiņas, kas saduras, to dara efektīvi, bet triecieni, kuru rezultātā tiek sadalīti reaģentu saites un jaunu saišu veidošanās ir tās, kas notiek pareizā orientācijā un ar enerģiju pietiekami.
Zemāk parādīts divu neefektīvu sadursmju un vienas efektīvas sadursmes gadījums, kura rezultātā notiek reakcija.
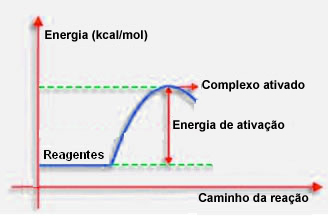
4.Aktivizācijas enerģija un aktivētais komplekss:
Kā norādīts iepriekšējā punktā, efektīvai sadursmei papildus labvēlīgai vadībai ir nepieciešama arī pietiekama enerģija. Minimālo enerģijas daudzumu, kas nepieciešams katras reakcijas norisei, sauc par aktivācijas enerģiju.
Ja reaģentu enerģija ir vienāda vai lielāka par aktivācijas enerģiju, labi orientēta šoka laikā: veidosies sākotnēji aktivizēts komplekss, kas ir starpstruktūra starp reaģentiem un produktiem. Aktivētajā kompleksā veidojas novājinātas reaģentu saites un jaunu produktu saites.
Tādējādi aktivācijas enerģija darbojas kā sava veida barjera reakcijas rašanās procesam, jo jo lielāka tā ir, jo grūtāk būs notikt reakcijai. Dažos gadījumos ir nepieciešams piegādāt enerģiju reaģentiem. Piemēram, vārāmajai gāzei ir afinitāte mijiedarboties ar gaisā esošo skābekli, bet mums jāsniedz enerģija, kad mēs savācam sērkociņu, pretējā gadījumā reakcija nenotiek. Bet, kad reakcija sākusies, tā pati atbrīvo pietiekami daudz enerģijas, lai aktivizētu citas molekulas un uzturētu reakciju.
Autore Jennifer Fogaça
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/condicoes-para-ocorrencia-reacoes-quimicas.htm
