notiek ar transformācijaizohorisks kad noteiktā gāzes masā notiek izmaiņas temperatūra kas izraisa spiediena izmaiņas vai otrādi, ņemot vērā šo temperatūru un spiediens, šajā gadījumā ir tieši proporcionāli lielumi, savukārt sistēmas tilpums nemainās.
Skatīt arī: Kas ir gāzu daļējais spiediens?
Kas ir izohoriska transformācija?
Izohoriska transformācija ir tad, kad temperatūras un spiediena izmaiņas notiek ar noteiktu gāzes masu, bet tās tilpums paliek nemainīgs. Spiediena izmaiņas būs tieši proporcionālas temperatūrai, tas ir, ja gāze noteiktā slēgtā sistēmā dubulto absolūto temperatūru, tas izraisīs spiediena pieaugumu līdz divreiz lielākam par sākotnējo.
Tiek saukta arī šāda veida transformācija izovolumetrisks vai izometrisks. Izohoriskais termins nāk no grieķu valodas Izokhora, uz ko iso nozīmē "vienāds" un khora nozīmē “vieta vai tilpums” (šajā kontekstā).
Piemēri:
Automašīnas riepām notiek izohoriska transformācija, to varam novērot, kad to izgatavojam kalibrēšana. Karstās dienās kalibrēšanas monitorā dotais spiediens ir lielāks nekā aukstajās dienās. Tas ir tāpēc, ka, paaugstinoties temperatūrai, spiediens palielinās, jo tilpums paliek.

Citi piemēri ir izsmidzināmie dezodoranti, šāda veida produktos uz etiķetes ir brīdinājums, ka tos nedrīkst uzglabāt vai pakļaut augstām temperatūrām, jo papildus dažām tā vielām ir viegli uzliesmojošas, pastāv izohora vai izovolumetrisks. Tā kā aerosola dezodoranti atrodas noslēgtā pudelē un gāzveida stāvoklī, temperatūras paaugstināšanās izraisīs spiediena palielināšanos un eksplozijas risku.
Izohoriskas transformācijas raksturojums
- Pastāvīgs tilpums.
- Spiediens un temperatūra ir tieši proporcionāli.
Šīs īpašības var aprakstīt pēc šādām formulām:

Izohoriskas funkcijas grafiks
Ņem vērā šo tabulu, kurā aprakstīta gāzes darbība attiecībā pret spiedienu, temperatūru un iegūto konstanti.
Temperatūra (° C) |
Spiediens (atm) |
P / T = nemainīgs |
50 |
5 |
10 |
100 |
10 |
10 |
150 |
15 |
10 |
200 |
20 |
10 |
Ņemiet vērā, ka spiediens seko temperatūras paaugstinājumam tā, ka P / T attiecība paliek nemainīga, kas nozīmē, ka spiediens un temperatūra ir tieši proporcionāli lielumi. Tāpēc grafiks, kas apraksta izohoras transformācijas, ir lineāra tipa. Skaties:

Kas atklāja izohorisko transformāciju?
Žaks Aleksandrs Sezārs Čārlzs (1746-1823) bija franču zinātnieks, kurš, pētot gāzu uzvedību slēgtā sistēmā, lai izveidotu precīzu termometru, pabeidza pētījumus par izohoriskām transformācijām.
Zinātnieks Džozefs Luiss Gajs-Lusaks (1778-1850) arī izstrādāja pētījumu par gāzveida sistēmas paplašināšanos un saraušanos. Tās bija neatkarīgas analīzes, taču, tā kā tās nonāca pie viena secinājuma, tās sadalīja kredītus. Šodien daži autori atsaucas uz pēdējiem diviem gāzu fiziskajiem likumiem, kas izskaidro izobariskās transformācijas un līdzīgi izohoriskiem Čārlza-Gaja-Lusaka 1. un 2. likums.
Skatīt arī: Geju-Lusaka tilpuma likums
Vingrinājumiatrisināts
Jautājums 1 - (PUC-RJ) Velosipēda riepa tiek kalibrēta pie 4 atm spiediena aukstā dienā 7 ° C temperatūrā. Ievadītās gāzes tilpums un daudzums ir vienādi. Kāds būs kalibrēšanas spiediens riepā, kad temperatūra sasniegs 37 ° C?
a) 21,1 atm
b) 4,4 atm
c) 0,9 atm
d) 760 mmHg
e) 2,2 atm
Izšķirtspēja
A alternatīva
1. solis: identificējiet sistēmu un iegūstiet datus.
Izovolumetriskā sistēma
P1 = 4 atm
T1 = 7 ° C
T2 = 37 ° C
P2 =?
Izmantojot formulu:
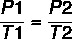
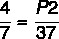
7 x P2 = 37 x 4
P2 = 148/7
P2 = 21,14 atm
2. jautājums - (Unifor-CE) Pārbaudiet zemāk redzamo attēlu.
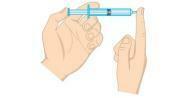
Gāzes spiedienu šļircē var samazināt:
a) šļirces ievietošana ledus ūdenī, turot galu aizvertu.
b) izspiežot virzuli, turot galu aizvertu.
c) šļirces ievietošana karstā ūdenī, turot galu aizvertu.
d) atverot galu un pusi no gaisa izvadot no šļirces.
e) pavelciet virzuli, turot galu atvērtu.
Izšķirtspēja
A alternatīva Gāzes spiediens ir tieši proporcionāls temperatūrai izohoriskajā sistēmā, tas ir, nemainot gāzes tilpumu vai masu. Kad pazeminās temperatūra, samazināsies arī spiediens.
Autors Laysa Bernardes Marques de Araujo
Ķīmijas skolotājs
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/transformacao-isocorica.htm
