veidošanās entalpija, ko sauc arī par veidošanās standarta entalpijavai standarta veidošanās siltums, ir siltuma aprēķins, kas atbrīvots vai absorbēts, veidojot 1 molu vielas no vienkāršām vielām, standarta stāvoklī.
Nav iespējams aprēķināt katras vielas entalpiju absolūto vērtību, bet ar kalorimetru ir iespējams aprēķināt entalpijas variāciju, kas notiek reakcijā.
Tas ir jāatceras tika panākta vienošanās pieņemt entalpijas vērtību, kas vienāda ar nulli vienkāršām vielām standarta stāvoklī. Tādējādi, ja mēs vēlamies uzzināt, kāda ir vielas veidošanās entalpija, mums jāzina tikai tās veidošanās reakcijas entalpijas vērtība no vienkāršām vielām.
Piemēram, mēs vēlamies atrast 18 gramu ūdens entalpiju, kas atbilst 1 mol, jo tās molārā masa ir 18 g / mol. Lai to izdarītu, mums vispirms ir nepieciešama reakcija, lai no vienkāršām vielām izveidotu ūdeni, kā parādīts zemāk:
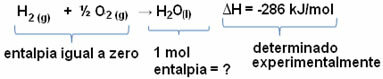
Ņemiet vērā, ka entalpijas izmaiņu vērtība, kas notika šajā reakcijā, eksperimentāli tika noteikta ar kalorimetru un ir vienāda ar -286 kJ / mol.
Formula, kas aprēķina šīs entalpijas izmaiņas (ΔH), ir:
ΔH = HProdukti - HReaģenti
Tādējādi, tā kā mēs jau zinām ΔH vērtību un ka reaģentu entalpija ir vienāda ar nulli (jo tās ir vienkāršas vielas standarta stāvoklī), mēs varam secināt ka 1 mol ūdens entalpijas vērtība ir vienāda ar veidošanās reakcijas entalpijas izmaiņām, jo tas ir vienīgais šīs reakcijas produkts, kā parādīts zemāk:
ΔH = HProdukti - HReaģenti
-286 kJ / mol = HH2O - (HH2 + H1/2 O2)
-286 kJ / mol = HH2O - 0
HH2O = - 286 kJ / mol
Nepārtrauciet tūlīt... Pēc reklāmas ir vēl vairāk;)
Šis entalpijas veids, kas iegūts no vienkāršu vielu entalpijas standarta stāvoklī, ir veidošanās standarta entalpija (ΔH0).
Tagad ir daudzas vielas, kuras neveidojas tieši vienā reakcijā, piemēram, ūdens. Šādos gadījumos veidošanās entalpiju var aprēķināt pēc reakcijas entalpijas variācijas.
Piemēram, NH4Cl veidojas šādā reakcijā:
NH3 + HCl → NH4Cl ΔH = -176 kJ / mol
Ņemiet vērā, ka neviens no reaģentiem nav vienkārša viela, tāpēc mēs nevaram viņiem piešķirt nulles entalpiju. Mums jāzina katra reaģenta veidošanās entalpijas, jo tās veido reakcijas starp vienkāršām vielām:
NH3: ΔH = -46 kJ / mol
HCl: ΔH = -92,4 kJ / mol
Saskaitot šīs divas entalpijas kopā, mēs iegūstam reaģentu entalpijas vērtību un varam atrast NH entalpiju4Cl:
HR = HNH3 + HHCl
HR = (-46 + (-92,4) kJ / mol)
HR = -138,4 kJ / mol
Aizstājot formulu:
ΔH = HProdukti - HReaģenti
-176 = HNH4Cl - ( -138,4)
HNH4Cl = - 176 - 138,4
HNH4Cl = -314,4 kJ / mol
Šajā gadījumā mēs tieši summējām reaģentu veidošanās entalpiju vērtības, jo reakcijas attiecība bija tikai 1 mol. Tomēr, ja citās reakcijās molu daudzums ir atšķirīgs, vispirms būs jāreizina reaģenta veidošanās entalpija ar molu skaitu.
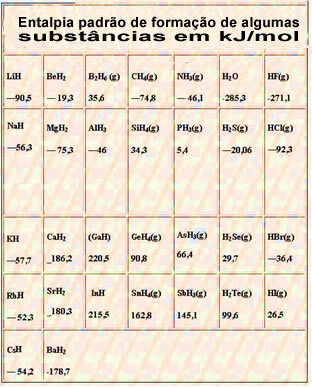
Zemāk ir tabula ar dažu vielu standarta entalpiju 25 ° C un 1 atm temperatūrā:
Autore Jennifer Fogaça
Beidzis ķīmiju
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
FOGAÇA, Jennifer Rocha Vargas. "Veidošanās entalpija"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/entalpia-formacao.htm. Piekļuve 2021. gada 27. jūnijam.