Atom ir vārds, kas dots matērijas veidotājam (visam, kas aizņem vietu un kam ir masa). Šo nosaukumu ierosināja grieķu filozofi Demokrits un Leipips. Ķīmiskie elementi, molekulas, vielas un organiskos vai neorganiskos materiālus veido atomi.
Konstitūcijā atomam ir daļiņas (protoni, neitroni un elektroni), kas nav mazākā matērijas daļa. Tomēr jūsu vizualizācija nav iespējama. Tas, kas ir zināms par atomu, ir saistīts ar zinātniski pierādītiem fizikālajiem, ķīmiskajiem un matemātiskajiem aspektiem.
Zināšanu attīstība par atomu ir izraisījusi vairāku tehnoloģiju attīstību un uzlabošanu.
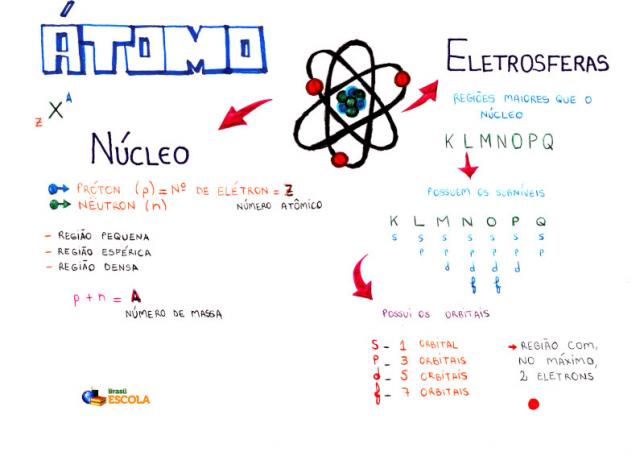
Atoma pamatsastāvs
Kodols: blīvāks atoma apgabals un tur protonus un neitronus;
Enerģijas līmeņi: reģioni, kas ieskauj kodolu, un tajā atrodas apakšlīmeņi, orbitāles un elektroni. Ir septiņi enerģijas līmeņi, kurus attēlo burti K, L, M, N, O, P un Q;
Enerģijas apakšlīmeņi: ir reģioni, kuros atrodas orbitāles. Tie atrodas visos līmeņos, un tos attēlo burti (s, p, d f). Tās daudzums ir atkarīgs no katra līmeņa: K (ir s apakšlīmenis), L (ir s un p apakšlīmenis), M (ir s, p un d apakšlīmenis), N (ir apakšlīmenis s, p, d un f), O (ir apakšlīmenis s, p, d un f), P (ir apakšlīmenis s, p un d) un Q (ir apakšlīmenis s un P);
Atomu orbitāles: reģioni, kas, visticamāk, atradīs elektronu. Katrā apakšlīmenī ir atšķirīgs orbitāļu skaits: s (viena orbitāle), p (trīs orbitāles), d (piecas orbitāles) un f (septiņas orbitāles);
protoni: pozitīvās daļiņas (ko apzīmē ar p);
elektroni: negatīvās daļiņas, kurām ir arī viļņu uzvedība (apzīmē ar e);
neitroni: neuzlādētas daļiņas, kas samazina atgrūšanu starp protoniem kodolā (apzīmē ar n).
Prāta karte: Atom
* Lai lejupielādētu domu karti PDF formātā, Noklikšķiniet šeit!
atoma attēlojums
Vienkāršākais veids, kā attēlot atomu, ir izmantot tā veidotā ķīmiskā elementa saīsinājumu. Akronīms Se, piemēram, apzīmē visus atomus, kas veido ķīmisko elementu selēns.
Akronīms, kas apzīmē atomu, joprojām var sniegt divas svarīgas informācijas daļas: atoma numuru (kuru apzīmē ar burtu Z un vienmēr kreisajā pusē atoma akronīma apakšdaļa) un masas numurs (ko apzīmē ar burtu A, kuru var novietot kreisajā vai labajā pusē atoma akronīma augšdaļā atoms).
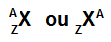
Atoma saīsinājums ar masas numuru un atoma skaitli
atomu skaitlis (Z): norāda atomu kodolā esošo protonu skaitu un enerģijas līmeņos esošo elektronu (e) skaitu.
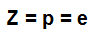
Formula, kas norāda atomu skaitļa reprezentativitāti
Masas numurs (A): norāda masu, kas atrodas atoma kodolā, kas rodas no protonu skaita (p) un neitronu skaita (n) summas.

Formula, kas norāda masas skaitļa reprezentativitāti
Atomu līdzības
Viena un tā paša ķīmiskā elementa vai dažādu ķīmisko elementu atomus protonu, elektronu, neitronu skaita un masas ziņā var salīdzināt šādi:
a) Izotopi
Tie ir atomi, kuriem ir:
viens un tas pats atomu skaitlis;
vienāds protonu skaits;
atšķirīgs masas numurs;
atšķirīgs neitronu skaits;
Piemērs:
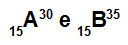
Atomi A un B ir izotopi
A un B atomi ir izotopi, jo:
Atomā A ir 15 protoni, atomu skaitlis ir vienāds ar 15, 15 elektroni, 15 neitroni un masas skaitlis ir vienāds ar 30.
Atomā B ir 15 protoni, atomu skaitlis ir vienāds ar 15, 15 elektroni, 20 neitroni un masas skaitlis ir vienāds ar 35.
b) Izobāri
Tie ir atomi, kuriem ir:
dažādi atomu skaitļi;
atšķirīgs protonu skaits;
atšķirīgs elektronu skaits;
tie paši masas numuri;
atšķirīgs neitronu skaits.
Piemērs:
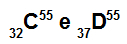
C un D atomi ir izobari
C un D atomi ir izobariski, jo:
Atom C ir 32 protoni, atomu skaitlis ir vienāds ar 32, 32 elektroni, 23 neitroni un masas skaitlis ir vienāds ar 55.
Atom D ir 37 protoni, kuru atomu skaitlis ir vienāds ar 37, 37 elektroni, 18 neitroni un masas skaitlis ir vienāds ar 55.
c) Izotoni
Tie ir atomi, kuriem ir:
dažādi atomu skaitļi;
atšķirīgs protonu skaits;
atšķirīgs elektronu skaits;
dažādi masas numuri;
tikpat daudz neitronu.
Piemērs:
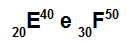
Atomi E un F ir izotopi
E un F atomi ir izotopi, jo:
Atomā E ir 20 protoni, atomu skaitlis ir vienāds ar 20, 20 elektroni, 20 neitroni un masas skaitlis ir vienāds ar 40.
Atomam F ir 30 protoni, kuru atomu skaitlis ir vienāds ar 30, 30 elektroniem, 20 neitroniem un masas skaitlis ir vienāds ar 50.
d) izoelektronika
Tie ir atomi, kuriem ir:
vienāds elektronu skaits.
PIEZĪME: izoelektroniskajiem atomiem var būt arī vienāds masas numurs (izobāri), vienāds neitronu (izotonu) vai vienāds protonu (izotopu) skaits.
Piemērs:
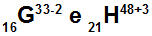
G un H atomi ir izoelektroniski
G un H atomi ir izoelektroniski, jo:
Atomā G ir 16 protoni, atomu skaitlis ir vienāds ar 16, 18 elektroni (zīme -2 norāda, ka tajā ir vēl divi elektroni nekā protonu skaits), 17 neitroni un masas skaitlis ir vienāds ar 33.
Atomā H ir 21 protons, atoma skaitlis ir vienāds ar 21, 18 elektroni (zīme +3 norāda, ka tajā ir par trim mazāk elektronu nekā protonu skaitā), 27 neitroni un masas skaitlis ir vienāds ar 48.
Autors: Diogo Lopes Dias
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-atomo.htm
