Jūs metāli tie ir ķīmiski elementi, kuru galvenā fiziskā īpašība ir spēja zaudēt elektronus un līdz ar to veidot metāla katjonus. Šī iemesla dēļ viņi var izveidot divu veidu ķīmiskās saites: jonu un metāla saite.
jonu saite rodas, kad metāls mijiedarbojas ar metāla rakstura elementu, kas var būt a ametal vai ūdeņradis. Šāda veida saitē mums ir elektronu zudumi, ko rada metāli, un elektronu pieaugums, ko rada nemetāli vai ūdeņradis.
jau metāla saite ir izveidota starp viena metāla elementa atomiem. Šis saites veids notiek tikai starp viena metāla atomiem un tikai tāpēc, ka metāls nevar izveidot ķīmisku saiti ar citu atšķirīgu metāla elementu.
Metālu vispārīgās īpašības
Cietās vielas istabas temperatūrā, izņemot dzīvsudrabu;
Viņi ir izcili;
Viņiem ir augstas kušanas un viršanas temperatūras;
Tie parasti ir sudraba krāsā, izņemot zeltu, kas ir zelts, un varu, kas ir sarkanīgi;
Tīros metālus veido atomu kopas (viena ķīmiskā elementa), ko sauc par kristāla režģiem.
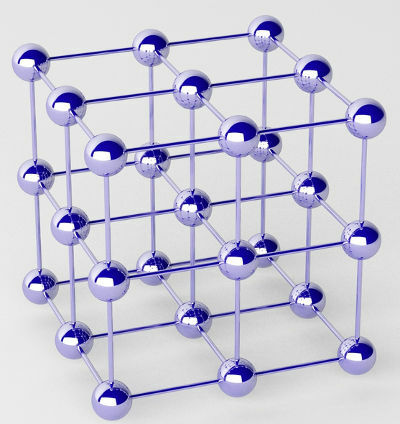
Metāla kristāliskā režģa attēlojums
Metāla savienošanas principi
Plkst metāla saitekristāliskie režģi, kas veido metālus, faktiski ir jonu kopa (sastāv tikai no katjonus un elektroni). Elektroni, kas atrodas metāla atomu valences slānī, ir delokalizēti, tas ir, tie atstāj valences slāni, kā rezultātā atoms kļūst par katjonu (trūkst elektronu).
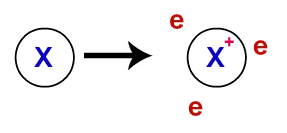
Delokalizēto elektronu attēlojums no valences apvalka
Pēc delokalizācijas elektroni no metāla atomiem sāk apņem katjonus, veidojot īstu “elektronu jūru”. Katram no šajā jūrā esošajiem elektroniem ir iespēja brīvi pārvietoties pa metāla kristālisko režģi.
Nepārtrauciet tūlīt... Pēc reklāmas ir vēl vairāk;)

Elektronu jūras modeļa attēlojums
PIEZĪME: Elektroni “no jūras” nespēj atstāt kristāla režģi un pārvietoties pa to.
Metālu īpašības, kas pamatotas ar metāla savienojumu
a) Kaļamība
Caur metālu ir iespējams izgatavot dažāda biezuma un loksnes. Pateicoties šim metālu īpašumam, mēs varam uzbūvēt dažādus priekšmetus, piemēram, nažus, zobenus utt.

Zobena asmens ir izgatavots no metāla
b) Vadītspēja
Metāli kopumā ir labi elektriskās strāvas un siltuma vadītāji. Ja kāds metāls ir saskarē ar siltuma avotu vai elektriskās strāvas avotu, tas spēj tos vadīt.

Alumīnija panna krāsns liesmā vadītspējas dēļ kļūst pilnīgi karsta.
c) Līdzdalība
Caur metālu mēs varam ražot vadus. Metāla izmantošana vadu veidā atvieglo tā izmantošanu, īpaši attiecībā uz elektrisko vadītspēju.

Vada ražošanai var izmantot metālu, piemēram, varu.
Autors: Diogo Lopes Dias
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
DIENAS, Diogo Lopes. "Kas ir metāla saistīšana?"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ligacao-metalica.htm. Piekļuve 2021. gada 27. jūnijam.
Ķīmija

Jonu saite, vienošanās starp jonu savienojumiem, jonu aglomerātiem, nātrija hlorīdu, galda sāli, jonu vielu, elektrostatiskās pievilkšanās spēki, hlorīda anjoni, nātrija katijoni, polārie šķīdinātāji, pozitīvie joni, katjoni, negatīvie joni, anjoni.

