aktīvie izomēri vai optiski aktīvi izomēri (IOA) ir noteiktas ķīmiskas vielas molekulas, kas var veikt polarizāciju un novirzi no plāns gaisma pa labi vai pa kreisi. Lai pārbaudītu, vai vielai ir vai nav aktīvie izomēri, vienkārši pārbaudiet, vai tās strukturālajā formulā ir asimetrisks ogleklis:

Analizējot iepriekš attēlā attēloto ķēdi, mēs varam redzēt, ka centrālajam ogleklim ir četri dažādi ligandi (OH, H, CH3 un Cl), kas padara to par a ogleklis asimetrisks, ko sauc arī par oglekli kirāls. Tādējādi vienmēr, kad ķēdē ir viens vai vairāki kirālie ogļi, būs aktīvi izomēri.
Jūs aktīvo izomēru veidi(IOA) viņi ir:
Labās puses: Aktīvs optiskais izomērs, kas liek polarizēto gaismu pa labi;
Levogiro: Aktīvs optiskais izomērs, kas liek polarizēto gaismu pa kreisi.
Novērojums: Asimetriskā oglekļa klātbūtne strukturālajā formulā norāda, ka vielai jābūt ar rotējošo izomēru un dekstrotorālo izomēru. Ne mums ir jāzina, uz kuru pusi gaisma tika novirzīta, jo kirālā oglekļa klātbūtne jau pierāda šo faktu. Vienmēr puse no esošajām molekulām ir kreilis, bet otra puse - ar labo roku.
Jebkuras organiskas vielas kreisās un labās rokas molekulām vienmēr ir vienādas fizikālās īpašības (punkts kušanas, viršanas temperatūra, blīvums, šķīdība utt.), bet ir ķīmiskas aktivitātes (uzvedība organismā) daudz dažādu. Piemērs ir adrenalīns. Ķermenī darbojas tikai adrenalīna rotējošā molekula, bet dekstrotoratīvā molekula nedarbojas.
Nepārtrauciet tūlīt... Pēc reklāmas ir vēl vairāk;)
Tagad pārbaudiet butān-2-ol vielas strukturālo formulu, lai pārbaudītu, vai tajā ir vai nav aktīvie izomēri:
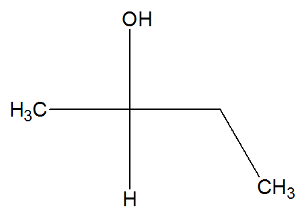
Butān-2-ola struktūrā mēs varam novērot, ka ogleklis 2 ir četras dažādas saistvielas (OH, H, CH3, CH2-CH3), tāpēc tas ir kirāls ogleklis un uzrāda dekstrorotējošu aktīvo izomēru un citu levorotāri aktīvo izomēru.
Aktīvo izomēru (IOA) aprēķins
Nīderlandes ķīmiķis Džeikobs Henriks van't Hofs izstrādāja formulu, kas ļauj aprēķināt, cik aktīvo izomēru (IOA) konkrētā viela var saturēt. Skaties:
IOA: 2Nē
n: ir chirālo ogļūdeņražu skaits vielas strukturālajā formulā.
Izpildiet divus Vant't Hoff formulas piemērošanas piemērus:
5-dihlor-2,3-dihidroksiheksandēnskābe

Savienojuma strukturālajā formulā ir trīs kirālie ogļi vai asimetrisks, tāpēc:
IOA = 2Nē
IOA = 23
IOA = 8
2,3,4,5-tetrahidroksiheksanāls

Savienojuma strukturālajā formulā ir četri kirālie ogļi (sarkanas bultiņas) vai asimetrisks, tāpēc:
IOA = 2Nē
IOA = 24
IOA = 16
Novērojums: Pastāv iespēja, ka strukturālajai formulai ir divi asimetriski ogļi, kuriem ir tieši tādi paši ligandi. Ja tas notiek, aprēķinos mēs ņemam vērā tikai 1 vērtību n, nevis 2. Skatiet piemēru:
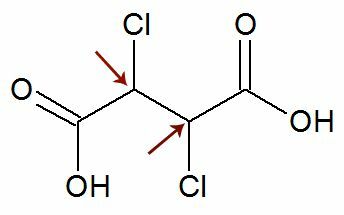
Patīk divi kirālie ogļi viņi ir ir vienāds, mēs uzskatām tikai vienu ogleklis aprēķinā:
IOA = 2Nē
IOA = 21
IOA = 2
Autors: Diogo Lopes Dias
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
DIENAS, Diogo Lopes. "Aktīvie izomēri"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/isomeros-ativos.htm. Piekļuve 2021. gada 27. jūnijam.