Sulfonēšanas reakcijas alkānos viņi ir organiskās aizstāšanas reakcijas, ko veic ar mērķi ražot sulfonskābes (organiskie savienojumi, kuriem ir SO grupa3Pie oglekļa atoma vai oglekļa ķēdes) un ūdeni (H2O).
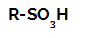
Sulfonskābes strukturālā formula
Sulfonēšanas reakcijas veikšanai alkāni, mums jāsajauc alkāns (savienojums, ko veido oglekļa ķēde, kas piesātināta tikai ar oglekļa un ūdeņraža atomiem) un sērskābe (H2TIKAI4) koncentrēts, pakļauts karsēšanai (∆).
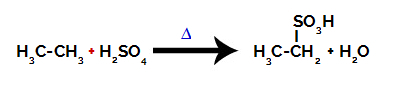
Ķīmiskais vienādojums, kas attēlo divu oglekļa alkāna sulfonēšanu
Sulfonēšanas reakcijas principi alkānos
Tāds kā alkāna sulfonēšanas reakcija tā ir aizstāšanas reakcija, tajā notiek apmaiņa starp mazākiem komponentiem elektronegativitāte reaģentu, tas ir, starp alkānu un sērskābi. Alkānā ir ūdeņradis un sulfoskābe - sērskābe.
Zemāk mums ir soli pa solim a mehānisms sulfonēšanas reakcija alkānos. Kā piemēru mēs izmantosim vienkāršāko alkānu - metānu (CH4):
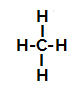
Metāna strukturālā formula
1. solis: Saites pārtraukšana starp hidroksilgrupu (OH) un sēru (S) sērskābē.
Katru hidroksilgrupu, kas atrodas sērskābē, raksturo tā, ka tā ir vairāk elektronegatīva. Sildot reakcijas laikā, tiek novērota saikne starp hidroksilgrupu un sēru:
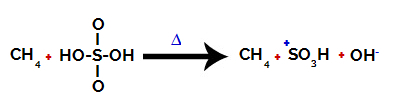
Sēra un hidroksila saites pārtraukšana
Tomēr visu hidroksilu saites pārrāvums nenotiek struktūras elektroniskās pārkārtošanās dēļ. Pēc tam iegūst hidroksīda anjonu (OH).-) un sulfonkajonu.
2. solis: Hidroksilgrupas uzbrukums alkāna molekulai.
Tad hidroksilgrupa (OH-) veic uzbrukumu alkānam, izraisot saiknes starp oglekli un ūdeņradi (kas ir trauslāka elektronegativitātes atšķirību dēļ starp tām) pārrāvumu.
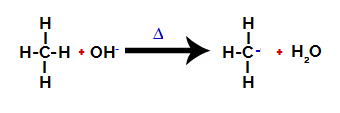
Sadales pārtraukšana starp oglekli un ūdeņradi alkānā
Piezīme: Saites pārtraukšana starp oglekli un ūdeņradi vienmēr notiek uz oglekļa ar zemāku elektronisko blīvumu vai lādiņu. Jo mazāk ogļūdeņražu ir ogleklim vai jo vairāk tam pievienotas grupas, jo zemāks ir tā elektronu blīvums. Tātad mums ir:
Terciārais ogleklis
Pēc saites pārrāvuma alkāns kļūst par oglekli, kurā trūkst elektronu (karbokācija). Hidroksīda grupa (OH)-) mijiedarbojas ar izdalīto ūdeņradi un veido ūdens molekulu.
3. solis: Izveidotā radikāļa uzbrukums sulfoniskajai grupai.
Visbeidzot, sulfongrupai uzbrūk pārējais alkāns, veidojot sulfonskābi.
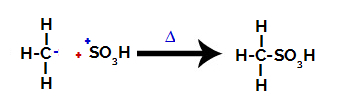
Struktūras, kas mijiedarbojas un veido sulfonskābi
Vienādojumu piemēri, kas attēlo sulfonēšanas reakcijas alkānos
1. piemērs: Propāna sulfonēšana.
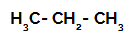
Propāna strukturālā formula
Propānam ir divi primārie ogļi un viens sekundārais ogleklis, kuriem ir atšķirīgi lādiņi, jo tie ir saistīti ar atšķirīgu ūdeņraža daudzumu. Tā kā ogleklis ir vairāk elektronegatīvs nekā ūdeņradis, šiem ogļiem ir atšķirīgs elektronu blīvums.
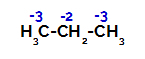
Lādiņu sadalījums katram propāna oglekļa atomam
Uz primārajiem oglekļiem lādiņš ir -3 (jo tas ir saistīts ar trim ūdeņražiem), un uz sekundārā oglekļa lādiņš ir -2 (jo tas ir saistīts ar diviem ūdeņražiem). Tādējādi saikne starp oglekli un ūdeņradi notiks, dažreiz pie oglekļa 1 (vienas molekulas), dažreiz pie oglekļa 2 (citas molekulas).
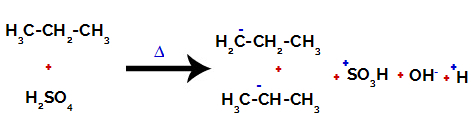
Pārtraucot saiti starp oglekli un ūdeņradi uz dažādiem oglekļiem
Pēc pārtraukumiem starp saitēm, gan sērskābē, gan alkānā, veidojas produkti, aizvietojot ūdeņradi uz oglekļa 1 ar sulfongrupu, un tas pats notiek uz oglekļa 2.
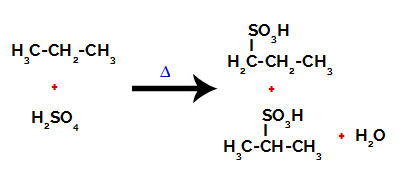
Produkti, kas veidojas no propāna sulfonēšanas
2. piemērs: 2-metilbutāna sulfonēšana.

2-metilbutāna strukturālā formula
2-metilbutānam ir trīs primārie ogļi, sekundārais un terciārais ogleklis dažādi lādiņi un līdz ar to arī atšķirīgs elektroniskais blīvums, kā redzams šādā struktūrā:
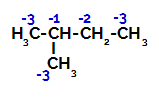
Elektronisko lādiņu sadalījums 2-metilbutānā
Tāpēc 2-metilbutānā ir vairākas iespējas pārtraukt saiti starp oglekli un ūdeņradi, kas var rasties uz oglekļa 1 (molekulas), oglekļa 2 (citas molekulas), oglekļa 3 vai oglekļa 4. Tomēr ir ievērības cienīgs fakts, ka traucējumi pie oglekļa skaitļa 2 ir biežāk sastopami.
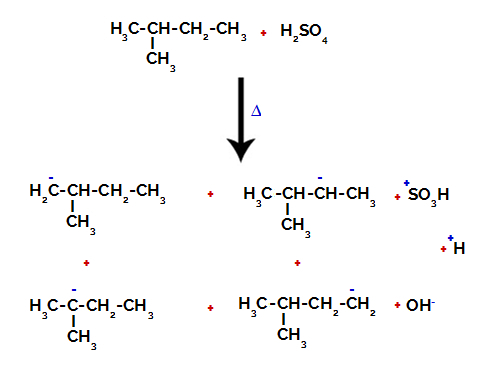
Pārtraucot saiti starp oglekli un ūdeņradi uz dažādiem oglekļiem
Pēc saites pārrāvuma gan sērskābē, gan alkānā izveidojas produkti, aizvietojot ūdeņradi uz oglekļa 1 ar sulfongrupu, un tas pats notiek uz ogleklis 2.

Produkti, kas veidojas no 2-metilbutāna sulfonēšanas
Autors: Diogo Lopes Dias
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/reacoes-sulfonacao-alcanos.htm
