neorganiskie sāļi tos veido vismaz viena katjona (ko veido jebkurš metāls vai amonijs) un anjona (vienkāršs vai savienots) jonu savienojums.
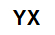
Sāls vispārējā molekulārā formula
Pievienojot ūdenim, sāļi disociējas, atbrīvojot vismaz vienu katjonu, izņemot hidroniju (H+) un anjonu, kas nav hidroksīds (OH-).
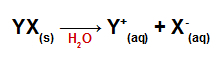
Jebkura sāls disociācijas vienādojums
Sāļu klasifikācija
Sāļiem var būt šādas klasifikācijas:
vienkāršs sāls: sāls, ko veido tikai viens katjons un viens anjons. Piemēri: NaCl, CaSO4, KCN, NH4CO3 utt.
Hidrogenēts sāls: tam ir divi katijoni (no kuriem vienam jābūt hidronijam) un anjons. Piemēri: NaHCO3, CaHBO3 utt.
Hidroksilsāls: tam ir katijons un divi anjoni (no kuriem vienam jābūt hidroksīdam). Piemēri: MgOHCl, Al (OH)2ClO3 utt.
Hidratēts sāls: uzrāda ūdens molekulas, kas saistītas ar tā kristālisko struktūru. Piemēri: CaCl2.2H2O, CuSO4.6H2Utt.
Dubultā sāls: tam ir divi katijoni (visi atšķiras no hidronija) un viens anjons vai viens katijons un divi anjoni (visi atšķiras no hidroksīda). Piemēri: tips4CN, AgFeBO3 utt.
Alumir sāls, ko veido divi sulfāti ar NOx katjoniem, kas vienādi ar +1 un +3, plus 24 ūdens molekulas. Piemēri: Ag2TIKAI4.Al2(TIKAI4)3.24H2uz2TIKAI4.Sb2(TIKAI4)3.24H2O
Sāls nosaukšanas noteikums
Anjona nosaukums + de + katjona nosaukums
→ K3Putekļi4
Sālī ir fosfāta anjons (PO4-3) un kālija katijons (K.+1), tāpēc tā nosaukums ir kālija fosfāts.
→ Lieta3
Sālim ir sulfīta anjons (SO3-2) un kalcija katjonu (Ca+2), tāpēc tā nosaukums ir kalcija sulfīts.
PIEZĪME: Ja katjons nav sudrabs, cinks vai elements, kas pieder IA, IIA un IIIA ģimenēm, mums katjona nosaukuma priekšā jānorāda tā NOX ar romiešu skaitli.
→ Cu2TIKAI4
Sāls satur sulfāta anjonu (SO4-2) un kalcija katjonu (Cu+1), tāpēc tā nosaukums ir vara sulfāts I.
Hidrogenēts sāls: Šim sālim pirms anjona nosaukuma mums jāieraksta prefikss, kas attiecas uz ūdeņraža daudzumu formulā. Šim prefiksam jābūt atsevišķi no vārda ūdeņradis ar defisi.
→ NaHCO3
Sāls satur ūdeņraža, karbonāta anjonu un nātrija katjonu, tāpēc tā nosaukums ir nātrija monohidrogēnkarbonāts.
Hidroksilsāls: Šim sālim pirms anjona nosaukuma mums jāieraksta prefikss, kas attiecas uz hidroksilu daudzumu formulā. Šim prefiksam jābūt atsevišķi no vārda hidroksi ar defisi.
→ Al (OH)2ClO3
Sālim ir divi hidroksili, hlorāta anjons un alumīnija katjons, tāpēc tā nosaukums ir alumīnija dihidroksihlorāts.
Hidratēts sāls: Šim sālim pēc katjona nosaukuma mums ir jāraksta prefikss, atsaucoties uz ūdens molekulu daudzumu formulā. Šim prefiksam jābūt atsevišķi no vārda hidratēts ar defisi.
→ CaCl2.2H2O
Sālī ir divas ūdens molekulas - hlorīda anjons un kalcija katjons, tāpēc tā nosaukums ir kalcija hlorīda dihidrāts.
Dubultā sāls ar diviem katjoniem: Šim sālim mums aiz anjona nosaukuma ir jāieraksta dubultvārds iekavās un pēc tam elektropozitīvākais katjona nosaukums un otrs katjons.
→ AgFeBO3
Šim sālim papildus borāta anjonam ir sudrabs (vairāk elektropozitīvu katjonu) un dzelzs II katijons. Tās nosaukums ir sudraba un dzelzs II borāts (dubultā).
-
Dubultā sāls ar diviem anjoniem:
Visvairāk elektronegatīvā anjona nosaukums + defise + vismazāk elektronegatīvā anjona nosaukums + de + katjona nosaukums
→ Tips4CN
Šis sāls papildus titāna IV katjonam satur fosfātu (vairāk elektronegatīvu anjonu) un cianīda anjonu. Tās nosaukums ir titāna cianīda fosfāts IV.
Alumīna sāls: Attiecībā uz šo sāli mēs ignorējam vispārējo noteikumu. Vienkārši uzrakstiet vārdu alum, kam seko attiecīgi +3 uzlādes katjona nosaukums un +1 uzlādes katjona nosaukums, atdalot tos ar savienojumu e.
→ In2TIKAI4.Sb2(TIKAI4)3.24H2O
Alumīna sāls satur +3 antimona katjonu un +1 nātrija katjonu, tāpēc tā nosaukums ir antimona III alum un nātrijs.
Sāļu fizikālās īpašības
Tie ir cieti istabas temperatūrā;
Viņiem ir augstas kušanas un viršanas temperatūras;
Tie veidojas no jonu saitēm;
Viņi vada elektrisko strāvu šķidrā stāvoklī (pēc kausēšanas) vai izšķīdinot ūdenī;
Vispārīgi runājot, tie šķīst ūdenī, bet ir sāļi, kurus uzskata par praktiski nešķīstošiem.
Sāļu ķīmiskās īpašības
Sāļi ir savienojumi, kas spēj ķīmiski reaģēt (ar nosacījumu, ka tiem nav tāda paša katjona vai tāda paša anjona kā citai vielai) ar vairākām vielu grupām, proti:
Divkāršās apmaiņas reakcijā ar skābi: tie veido jaunu sāli un jaunu skābi.
Divkāršās apmaiņas reakcijā ar bāzi: tie veido jaunu sāli un jaunu bāzi.
Iekšā dubultas apmaiņas reakcija ar citu sāli: veido divus jaunus sāļus.
Dažiem sāļiem piemīt spēja ciest sadalīšanās pakļaujot karstumam, veidojas divas vai vairākas jaunas vielas. Ja karsējam nātrija bikarbonātu (NaHCO3), piemēram, tas sadalīsies, veidojot nātrija karbonātu (Na2CO3), ūdens (H2O) un oglekļa dioksīdu (CO2).
Autors: Diogo Lopes Dias
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-sao-sais-inorganicos.htm

