elektronegativitāte tā ir atoma tieksme piesaistīt sev elektronus, kad tas ir saistīts ar citu ķīmisko elementu. caur kovalento saiti, tas ir, kurā notiek elektronu koplietošana, uzskatot šo molekulu par izolēts.
Apskatīsim divus piemērus, lai labāk izprastu piedāvāto koncepciju:
1. piemērs: ūdeņraža gāzes molekula: H2 → H - H
Kad sanāk divi ūdeņraža atomi, vienlaikus rodas pievilkšanās spēki starp katra kodolu. viens no šiem atomiem ir otra atoma elektrons un atgrūšanas spēki starp elektroniem un abu kodolu atomi. Kad šie spēki sasniedz līdzsvaru, divi elektroni atrodas elektrolodīšu apgabalā, kas atrodas kaut kur starp abiem. molekulas atomi, kuros abi mijiedarbojas ar diviem elektroniem, kļūstot stabili, tas ir, abiem atomiem ir kopīgs pāris elektroni.
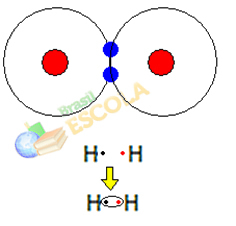
Šī ir kovalentā saite, kas veido molekulu. Bet, tā kā abi šīs molekulas atomi ir tieši vienādi, arī tas, kā tie piesaista elektronus viens otram, ir vienāds. Tāpēc mēs to sakām elektronegativitātes atšķirības nav vai ka viņa tas ir apolārs.
2. piemērs: ūdeņraža hlorīda molekula: HCℓ
Šajā gadījumā elektronu pāra koplietošana tiek veikta starp dažādiem elementiem, jo šajā sakarā hlora atoms piesaista elektronus ar lielāku intensitāti nekā ūdeņradis. Tāpēc mēs sakām, ka hlors ir vairāk elektronegatīvs nekā ūdeņradis.
Kā parādīts zemāk redzamajā attēlā, elektronegativitātes atšķirības dēļ a elektriskais dipols (μ), kas ir divi elektriski monopoli, un elektronus mēdz vairāk piesaistīt hlors. Tātad saitei H ─ Cℓ būs daļējs negatīvs hlora lādiņš (δ-) un daļēju pozitīvu ūdeņraža lādiņu (δ+). Tātad šī ir molekula ar elektronegativitātes starpību un ir polārs:
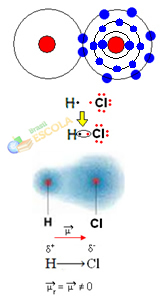
Tas mums parāda, ka elektronegativitāte ir relatīvs, nevis absolūts lielums, jo to nosaka, ņemot vērā kovalentās saites atomu radīto spēku salīdzinājumus.
Ir vairāki veidi, kā aprēķināt elektronegativitāti, taču visbiežāk tas notiek elektroninga aktivitātes skala, ko piedāvā Polinga. Pieņemsim, ka mums ir vispārīga molekula A ─ B. Polings ierosināja, ka šīs molekulas saistošo enerģiju, ko simbolizē D, izsaka ar saistošo enerģiju vidējās aritmētiskās summas summu (D) šo divu atomu gāzes molekulām, tas ir, A-A un B-B, ar šīs molekulas katra atoma elektronegativitātes starpības kvadrātu (x un xB):
D(A-B) = [D(A-A) + D(B-B)] + k (x - xB)2
Konstante k iepriekšminētajā formulā ir vienāda ar 96,5 kJ. mol-1. Paulings piešķīra patvaļīgu ūdeņraža elektronegativitātes vērtību, kas bija 2,1, un šādā veidā bija iespējams atklāt pārējo elementu elektronegativitātes vērtību attiecībā pret viņš.
Pamatojoties uz šo metodi, Pāvinga elektronegativitātes vērtības tika norādītas periodiskās tabulas elementiem, izņemot cēlās gāzes.

Ņemiet vērā, ka šīs vērtības ir periodiska īpašība, jo tās periodiski mainās atkarībā no elementu atomu skaita. Skatiet, piemēram, ka visvairāk elektronegatīvie elementi ir tie, kas atrodas tabulas augšējā labajā stūrī, tas ir, fluors (4.0) un skābeklis (3.5), un vismazāk elektronegatīvie ir tie, kas atrodas apakšējā kreisajā stūrī, kas ir franks (0,8) un cēzijs (0,8).
Pamatojoties uz to, tas pat tika izveidots visvairāk elektronegatīvo elementu elektronegativitātes rinda, kas parasti strādā visvairāk:
F> O> N> Cℓ> Br> I> S> C> P> H
Skatiet elektronegativitātes vērtības:
4,0 > 3,5 > 3,0 > 3,0 > 2,8 > 2,5 > 2,5 > 2,5 < 2,1
Lai izrotātu šo elektronegativitātes rindu, ir sava veida "triks", ko piešķir zemāk teiktais, kurā katra vārda iniciāļi atbilst attiecīgo elementu simbolam:
“FSveiki Onav NO Clube, bres dabūju EssAi Çmirst Ppriekš Hslimnīca"
Tāpēc mēs to varam teikt elektronegativitāte ir periodiska īpašība, kas periodiskajā tabulā palielinās no kreisās uz labo pusi un no apakšas uz augšu.

Tas notiek atoma rādiusa lieluma dēļ. Jo lielāks ir atoma rādiuss, jo tālāk kopīgi elektroni atrodas no tā kodola, un tāpēc vājāka pievilcība starp tiem. Tāpat ir tieši pretēji, jo mazāks atoma rādiuss, jo tuvāk elektroni būs kodolam un jo lielāka būs to pievilcība. Tādējādi mēs varam secināt šādi:
Elektronegativitāte palielinās, samazinoties atomu rādiusam.
Autore Jennifer Fogaça
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/eletronegatividade.htm

