Bāze ir neorganiska viela kas, pēc zviedru ķīmiķa domām Svante Arrhenius, ievietojot ūdenī, cieš jonu disociācija, kurā ir joni: katijons (Y+) un hidroksīda anjonu (OH-).

Arrhenius bāzes vispārējā formula
a grupa Y bāze tas var būt jebkurš metāls vai amonija grupas metāls (NH4+), kas disociācijas laikā izdalās ūdenī kā katjoni, kā redzams procesu raksturojošajā vienādojumā:
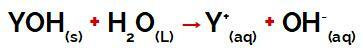
Vienādojums, kas attēlo bāzes disociāciju
Zemāk ir sniegta ļoti svarīga informācija par ES klasifikāciju un nomenklatūru bāzes.
1) Klasifikācija attiecībā uz bāzu šķīdība(spēja izšķīst ūdenī)
Bāzes šķīstošs: sastāvā ir sārmu metāls vai amonijs;
Bāzes maz šķīstošs: ir sārmu zemes metāls sastāvā. Piemērs: magnija hidroksīds, ko plaši izmanto kā antacīdu un caurejas līdzekli;
bāzes praktiski nešķīstošs: kompozīcijā ir kāds cits metāls. Piemērs: alumīnija hidroksīds, ko plaši izmanto kā antacīdu.
2) Klasifikācija attiecībā uz tautas spēks(spēja norobežoties ūdenī)
Bāzes spēcīgs: sastāvā ir sārmu vai sārmzemju metāli, izņemot magniju;
Bāzes vājš: kompozīcijā ir kāds cits metāls.
3) Bāzes nomenklatūra
Lai nosauktu bāzi, vienkārši izpildiet tālāk minēto nosaukšanas kārtulu:
Hidroksīds + de + metāla vai amonija nosaukums
Piemērs: Ca (OH)2 → kalcija hidroksīds
Ja bāzei ir ķīmiskais elements, kas nepieder pie IA, IIA vai IIIA saimes (un tas nav sudrabs vai cinks), elementa nosaukuma priekšā ar romiešu cipariem jānorāda skaitlis hidroksilgrupas:
Piemērs: Ti (OH)4 → titāna hidroksīds IV
Autors: es. Diogo Lopes
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-base.htm

