Oksidācijas-reducēšanās reakciju raksturo kā vienlaicīgu elektronu zuduma un pieauguma procesu, jo atoma, jona vai molekulas zaudētos elektronus uzreiz saņem citi.
Lai saprastu, skatiet piemēru:
Vara sulfāta šķīdums (CuSO4 (aq)) ir zils Cu jonu klātbūtnes dēļ2+ izšķīdis tajā. Ja mēs ieliekam metāla cinka plāksni (Zns)) šajā šķīdumā laika gaitā mēs varam pamanīt divas izmaiņas: šķīduma krāsa kļūs bezkrāsaina un uz cinka plāksnes parādīsies metāla vara nogulsnes.
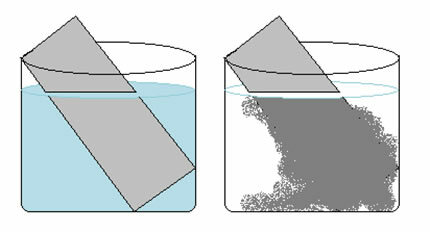
Tāpēc reakcija, kas notiek šajā gadījumā, ir šāda:
Zns) + CuSO4 (aq) → Cus) + ZnSO4 (aq)
vai
Zns) + Cu2+(šeit) + OS42-(šeit) → Cus) + Zn2+(šeit) + OS42-(šeit)
vai tomēr
Zns) + Cu2+(šeit) → Cus) + Zn2+(šeit)
Ņemiet vērā, ka notika elektronu pārnese no cinka uz varu. Analizējot transformāciju, kas notika katrā no šiem elementiem, mums ir:
- Zns) → Zn2+(šeit)
Cinks zaudēja 2 elektronus, pārejot no metāla cinka uz katjonu. Tādā gadījumā, cinks ir oksidējies.
- Ass2+(šeit) → Cus)
Ar varu notika pretējais, tas ieguva 2 elektronus, pārejot no vara II katjona uz metāla varu. Varš ir samazināts.
Tas izskaidro divas novērotās izmaiņas, jo šķīdums kļuva bezkrāsains, jo vara joni tika pārveidoti par metāla varu, kas nogulsnējās uz cinka plāksnes.
Tā kā vienlaikus notika elektronu zudums un pieaugums, šī reakcija ir redoksreakcijas piemērs, un caur to mēs varam izveidot šādus jēdzienus, kas tiek atkārtoti attiecībā uz visām pārējām šī reakcijām tips:

Visreaktīvākais metāls tiek oksidētsTādējādi piedāvātajā piemērā cinks ir vairāk reaktīvs nekā varš.
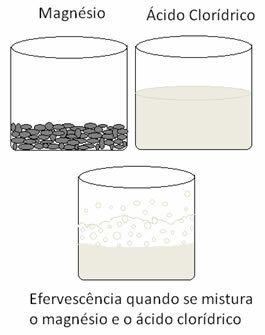
Vēl viena redoksreakcija, uz kuru var atsaukties, rodas, kad mēs ievietojam magniju vai alumīniju sālsskābes šķīdumā. Šajās reakcijās ūdeņradis no sālsskābes saņem 3 elektronus no alumīnija (vai 2 elektronus no magnija), nododot to no H katjona+ ūdeņraža gāzei (H2), kamēr metāls kļūst par katjonu:
2 Als) + 6 H+(šeit) → 2 Al3+(šeit) + 3H2. punkta g) apakšpunkts
mgs) + 2 H+(šeit) → Mg2+(šeit) + H2. punkta g) apakšpunkts
Metāli oksidējas, ūdeņradis - reducējas. Zemāk redzams skaitlis, kas parāda, ka magnija pievienošana sālsskābei izraisa a putošana, kas rodas ūdeņraža izdalīšanās dēļ, un magnijs pazūd, kā tas ir patērēts.
Autore Jennifer Fogaça
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/reacoes-oxirreducao.htm
