A elektrosfēra ir atoma apgabals, kurā elektroni Tie atrodas. Precīzāk, elektrosfēra sastāv no atomu orbitālēm, kuras nosaka, atrisinot Šrēdingera vienādojumu. Pirmo reizi tika noteikts pēc Rutherforda modeļa, un Bora atomu modeļa derīguma laikā elektrosfēra saņēma ievērojamu progresu.
Elektrosfēru var sadalīt slāņos (vai enerģijas līmeņos), jo elektroniem ir noteikta (nepārtraukta) enerģija. Atomiem ar diviem vai vairākiem elektroniem apvalki sadalās apakščaulās (vai apakščaulās). Elektrosfēra ir ārkārtīgi svarīga, lai izprastu atoma īpašības un izprastu ķīmisko saišu veidošanos.
Izlasi arī: Kā tiek sadalīts atoms?
Tēmas šajā rakstā
- 1 - Elektrosfēras kopsavilkums
- 2. Video nodarbība par elektrosfēru
- 3 - Kas ir elektrosfēra?
- 4 - Elektrosfēras slāņi
- 5 - Elektrosfēras funkcija
- 6 - Elektrosfēras un atomu struktūras attiecības
- 7 - Atrisināti vingrinājumi uz elektrosfēras
Kopsavilkums par elektrosfēru
Elektrosfēra ir atoma apgabals, kurā atrodas elektroni.
To veido atomu orbitāles, viļņu funkcijas, kas ir Šrēdingera vienādojumu risinājumi.
Tās koncepcija sākās ar Ernesta Rezerforda modeli.
Elektroni tiek turēti elektrosfērā, pateicoties to piesaistei atoma kodolam.
Galvenie sasniegumi elektrosfēras izpratnē notika Nīlsa Bora modeļa koncepcijas laikā.
Tas sastāv no slāņiem (vai enerģijas līmeņiem), kas ir noteiktas enerģijas reģioni.
Atomiem ar vairāk nekā vienu elektronu čaulas sadalās apakščaulās (vai apakščaulās).
Elektrosfēra ir svarīga, lai izprastu vairākas īpašības, piemēram, atomu līdzību, stabilitāti, atomu rādiuss, jonizācijas enerģija, elektronu afinitāte, papildus izpratnei par saišu veidošanos ķīmiskās vielas.
Video nodarbība par elektrosfēru
Kas ir elektrosfēra?
Elektrosfēra ir definēta kā atomu struktūras apgabals, kurā atrodas elektroni. Padziļinātās interpretācijās mēs sakām, ka tas sastāv no atomu orbitālēm, viļņu funkcijām, kas ir Šrēdingera vienādojuma risinājumi. Atomu orbitāles matemātiskā izteiksme kvadrātā parāda elektrona atrašanās vietas varbūtības blīvumu noteiktā punktā.
O Elektrosfēras jēdziens sāka parādīties līdz ar Ernesta Rezerforda atomu modelis, kurā ir elektroni, kas riņķo ap blīvu, pozitīvu kodolu. Vēlāk Nīls Bors ieviesa nozīmīgākas elektrosfēras interpretācijas, sajaucot kvantu mehānikas jēdzienus.
Nepārtrauciet tagad... Pēc reklāmas ir vēl kas ;)
Elektrosfēras slāņi
Elektroni tiek turēti elektrosfērā, pateicoties to piesaistei atoma kodolam. Tomēr ir zināms, ka šie elektroni atrodas apvalkos, kuru enerģija ir labi noteikta. Šādus slāņus var saukt arī par enerģijas līmeņiem.
Šāds secinājums tika izdarīts pēc spektroskopijas eksperimentiem. Piemēram, ja gāzei H tiek pielietota elektriskā strāva2 Zemā spiedienā gaismu izstaro H2. Šajā stāvoklī veidojas H joni+ un elektroni, kas atgriezīsies H jonos+ un veidos satrauktas (enerģiskas) H sugas+. Lai atbrīvotu lieko enerģiju, H joni+ atbrīvot enerģiju elektromagnētiskā starojuma (gaismas) veidā un rekombinēties H gāzē2 atkal.
Jūs varat atcerēties, ka tad, kad balta gaisma iziet cauri prizmai, tā sadalās nepārtrauktā spektrā (līdzīgi kā varavīksnei); tomēr tas pats nenotiek ar gaismu, kas nāk no H2: kad šāds starojums iet caur prizmu, H emisijas spektrā tiek novērotas tikai spilgtas līnijas ar noteiktu viļņa garumu2, kas pazīstams kā spektrālās līnijas.
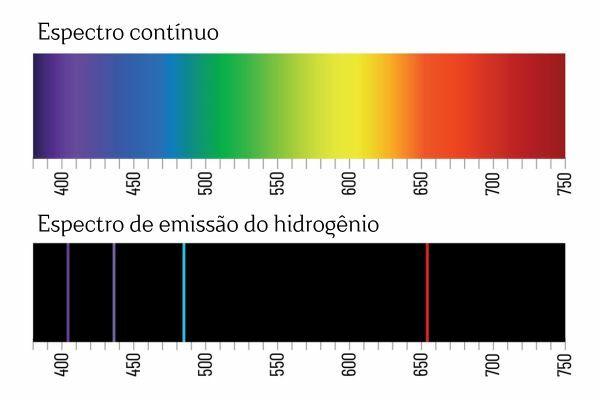
Elementu emisijas spektru (ar labi definētām spektra līnijām) interpretācija ir šāda: elektrons, atomā, nevar uzrādīt nekādu enerģiju, bet gan precīzi noteiktos daudzumos (tā sauktās enerģijas paketes). Ja elektroniem nebūtu šādu enerģētisko ierobežojumu, elementu emisijas spektrs būtu nepārtraukts, tāpat kā baltai gaismai, kas iet caur prizmu.
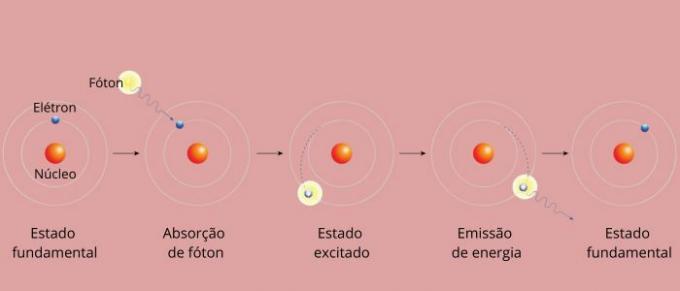
Katra elementa spektrālā līnija kļuva pazīstama kā enerģijas līmenis. (vai slānis, kā mēs vairāk esam pieraduši teikt). Šīs līnijas rodas, kad elektrons pāriet no viena atļautā enerģijas līmeņa uz citu enerģijas maiņas procesā, kas pazīstams kā elektroniskā pāreja.
Elektroniskās pārejas laikā elektrons pāriet no zemāka enerģijas līmeņa uz augstāku enerģijas līmeni. Atgriežoties sākotnējā līmenī, tas caur elektromagnētisko starojumu (gaismu) izstaro lieko enerģiju, dodot izcelsme uz spektra līniju, kuras izstarotā enerģijas vērtība ir proporcionāla vērtībai, kas noteikta ar vienādojumu Ridbergs.
Johannes Rydberg bija zviedru spektroskopists, kurš, pamatojoties uz Šveices profesora Johana Balmera darbu, izveidoja vienādojumu, lai definētu spektrālo līniju tendences. Katra slāņa īpatnējo enerģiju nosaka, atrisinot atbilstošo Šrēdingera vienādojumu.
Katrā elektroniskajā slānī ir atļauts elektronu skaits. Pašlaik ir definēti septiņi elektroniskie slāņi, kas apzīmēti ar burtiem K līdz Q alfabētiskā secībā vai ar burtu n, kur n ≥ 1. Tādējādi slānis K ir slānis, kur n = 1 un tā tālāk. Uz vienu apvalku atļautais elektronu skaits ir parādīts nākamajā tabulā.
Enerģijas līmenis |
Slānis |
Maksimālais elektronu skaits |
1 |
K |
2 |
2 |
L |
8 |
3 |
M |
18 |
4 |
N |
32 |
5 |
O |
32 |
6 |
P |
18 |
7 |
J |
8 |
Hidrogenoīdu atomiem (tikai ar 1 elektronu, piemēram, H, He+, Li2+), visām atomu orbitālēm ir vienāda enerģija (mēs tās saucam par deģenerētām orbitālēm); tomēr atomos ar diviem vai vairāk elektroniem rodas ļoti svarīgs efekts, elektronu-elektronu atgrūšanās. Šī fakta sekas ir tādas, ka katra slāņa orbitālēm sāk būt atšķirīga enerģija, un tāpēc slāņus sāk raksturot kā apakšslāņus (vai apakšlīmeņus).
Pašreizējiem atomiem katrs slānis var tikt sadalīts līdz četriem apakšlīmeņiem, kas apzīmēts ar burtiem “s” (no angļu valodas, asas), “p” (no angļu valodas, galvenais), “d” (no angļu valodas, difūzs) un “f” (no angļu valodas, fundamentāli).
Katrs apakšlīmenis atbalsta maksimālo elektronu skaitu, ko nosaka aprēķini un eksperimenti. “s” apakšlīmenis atbalsta līdz 2 elektroniem; “p” apakšlīmenis, līdz 6 elektroniem; “d” apakšlīmenis, līdz 10 elektroniem; un “f” apakšlīmenis, līdz 14 elektroniem. K slānis ir vienīgais, kas pieļauj tikai vienu orbitāli, un tāpēc tam ir tikai viens apakšlīmenis.
Enerģijas līmenis |
Slānis |
Apakšlīmeņi |
1 |
K |
1s |
2 |
L |
2s, 2p |
3 |
M |
3s, 3p, 3d |
4 |
N |
4s, 4p, 4d, 4f |
5 |
O |
5s, 5p, 5d, 5f |
6 |
P |
6s, 6p, 6d |
7 |
J |
7s, 7p |
Elektrosfēras funkcija
Katra atoma elektrosfēra var izmantot, lai izskaidrotu dažādas atoma īpašības un uzvedību.
Tādām īpašībām kā atoma rādiuss, jonu rādiuss, jonizācijas enerģija un elektronu afinitāte ir vērtības, kas ir tiešas sekas no elektrosfēras elektroniskās konfigurācijas, precīzāk sauc par valences apvalku, kas faktiski ir visattālāk aizņemtais atoma vai jona elektroniskais apvalks.
A līdzība starp atomiem no vienas un tās pašas grupas periodiskajā tabulā ir arī elektroniskās konfigurācijas sekas no valences apvalka. Ķīmiskajos procesos mēs izvēlamies atomus no vienas un tās pašas grupas periodiskajā tabulā aizvietotāji, un tas ir tikai ticami, jo šiem atomiem ir tāda pati elektroniskā konfigurācija slānī no valences.
Uz ķīmiskās saites, kas rodas starp atomiem, veidojot jonu un kovalentus savienojumus (molekulas), rodas arī mijiedarbībā starp atomu elektrosfērām.
Lasi arī: Šrēdingera atomu modelis - veids, kā aprakstīt atomu, izmantojot kvantu mehāniku
Elektrosfēras un atoma struktūras saistība
Kā minēts, elektrosfēra aptver atoma reģionu, kurā var atrast elektronus. Konkrētāk, elektroni atrodas atomu orbitālēs, kuru enerģija ir noteikta ar kvantu aprēķiniem.
Elektrosfēra ir lielākais atomu struktūras reģions, jo atoma kodols ir ļoti mazs. Domājot par atomu kā futbola stadionu, kodols atbilstu bumbai laukuma centrā, bet pārējā stadiona daļa būtu elektrosfēra.
Neskatoties uz to, masas ziņā elektrosfēra dod nelielu ieguldījumu. Tā kā elektronu masa ir aptuveni 1836 reizes mazāka nekā protonu un neitronu masa, mēs varam teikt, ka gandrīz visa atoma masa ir koncentrēta kodolā.
Atrisināja vingrinājumus elektrosfērā
jautājums 1
(Facisb 2023) Bora modelī ūdeņraža atomam elektrons var aizņemt tikai noteiktas orbītas. Dažas no šīm orbītām ir attēlotas attēlā, kur n attiecas uz enerģijas līmeņiem, kas elektronam ir katrā orbītā.
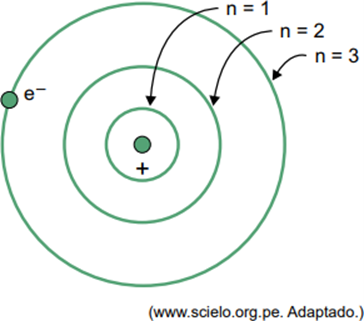
Apsveriet, ka ūdeņraža atomā elektrons atrodas orbītā, kur n = 5.
Saskaņā ar Bora modeli šis elektrons izstaros enerģiju elektromagnētiskā starojuma veidā tikai tad, kad
(A) veiciet pāreju uz orbītu, kurā n ir vienāds ar 6.
(B) paliek orbītā, kur n = 5.
(C) pāreja uz jebkuru orbītu, kurā n ir lielāks par 5.
(D) pāreja uz jebkuru orbītu, kurā n ir mazāks par 5.
(E) tiek izmests no atoma, jonizējot to.
Atbilde: D burts
Kad elektrons atrodas ārējā apvalkā, atgriežoties iekšējā apvalkā ar zemāku enerģiju, tas atbrīvo lieko enerģiju elektromagnētiskā starojuma (gaismas) veidā. Tāpēc gaisma parādīsies tikai tad, kad elektrons, kas atrodas n = 5, pāriet uz iekšējo apvalku.
2. jautājums
(Uerj 2019) Nesen zinātniekiem izdevās ražot metālisku ūdeņradi, saspiežot molekulāro ūdeņradi zem augsta spiediena. Šī elementa metāliskās īpašības ir tādas pašas kā citiem periodiskās klasifikācijas tabulas 1. grupas elementiem.
Šī līdzība ir saistīta ar šo elementu enerģētiskāko apakšlīmeni, kas atbilst:
(A) ns1
(B) n.p.2
(C) nav3
(D) nf4
Atbilde: A burts
Ūdeņraža atomam ir tikai viens elektrons, kas atrodas pirmajā līmenī, apakšlīmenī “s” (1s1). Viens no iemesliem, kāpēc tas ir atrodams periodiskās tabulas 1. grupā, ir tāpēc, ka visiem pārējiem ķīmiskajiem elementiem šajā grupā ir atomi, kuru valences apvalks ir tāda paša tipa (ns1). Tāpēc līdzīga valences slāņa dēļ ūdeņradi varēja ražot šajā metāliskajā formā.
Avoti:
DO CANTO, E. L.; LEITE, L. L. W.; KANTO, L. W. Ķīmija – ikdienā. 1. ed. Sanpaulu: Moderna, 2021. gads.
ATKINS, P.; DŽONS, L.; LAVERMANS, L. Ķīmijas principi: apšaubīt dzīvi un vidi. 7. ed. Porto Alegre: Bookman, 2018.
ATKINS, P.; DE PAULA, J.; KĪLERS, Dž. Atkinsa fizikālā ķīmija. 11. izd. Oksforda: Oxford University Press, 2018.
Vai vēlaties atsaukties uz šo tekstu kādā skolā vai akadēmiskajā darbā? Skaties:
NOVAIS, Stefano Araudo. "Elektrosfēra"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/eletrosfera.htm. Skatīts 2023. gada 10. novembrī.


