šķīdība vai šķīdības koeficients, tas ir matērijas fiziskais īpašums, ko laboratorijā vienmēr praktiski nosaka. Tas ir saistīts ar ietilpību, ko sauc par materiālu izšķīdis, dāvanas jāizšķīdina citai, šķīdinātājs.
Attiecībā uz šķīdību izšķīdušās vielas var klasificēt šādi:
Šķīdumi: tie, kas izšķīst šķīdinātājā. Piemēram, nātrija hlorīds (izšķīdis) šķīst ūdenī (šķīdinātājā);
Nedaudz šķīstošs: tie, kuriem ir grūti izšķīst šķīdinātājā. Tas attiecas uz kalcija hidroksīdu [Ca (OH)2] (izšķīdis) ūdenī;
Nešķīstošs: tie nešķīst šķīdinātājā. Piemēram, smiltis (izšķīdis) ūdenī nešķīst.
šķīdība ir ļoti saistīts ar risinājumus (viendabīgi maisījumi), jo, lai iegūtu šķīdumu, ir svarīgi, lai izmantotā izšķīdinātā viela šķīst šķīdinātājā.
Faktori, kas ietekmē šķīdību
Pat tad, kad izšķīdinātā viela šķīst šķīdinātājā, ir daži faktori, kas var ietekmēt izšķīdušās vielas spēju izšķīst. Vai viņi:
a) Izšķīdušās vielas un šķīdinātāja daudzuma attiecība
Šķīdinātājam vienmēr ir izšķīdušās vielas daudzums, ko tas var izšķīdināt. Ja mēs palielinām šķīdinātāja daudzumu, vienlaikus saglabājot izšķīdušās vielas daudzumu, šķīdinātājs mēdz izšķīdināt visu izmantoto izšķīdušo vielu.
B) Temperatūra
Temperatūra ir vienīgais fizikālais faktors, kas spēj mainīt šķīdinātāja šķīdību attiecībā pret konkrēto izšķīdušo vielu. Šī modifikācija ir atkarīga no izšķīdušās vielas veida, kā mēs redzēsim tālāk:
endotermiskā izšķīdinātā viela: ir tā, kuru mums izdodas izšķīdināt lielāku masu, ja vien šķīdinātājs atrodas temperatūrā, kas augstāka par istabas temperatūru. Jo karstāks ir šķīdinātājs, jo vairāk izšķīdušās vielas izšķīdīs.
Piemērs: Kad ūdens ir karsts, ir iespējams izšķīdināt lielāku daudzumu maltas kafijas.
Eksotermiskā izšķīdinātā viela: ir tā, ka mums izdodas izšķīdināt lielāku masu, ja vien šķīdinātāja temperatūra ir zemāka par istabas temperatūru. Jo vēsāks šķīdinātājs, jo vairāk izšķīdušās vielas izšķīdīs.
Piemērs: Kad soda ir auksta, ir iespējams izšķīdināt lielāku daudzumu oglekļa dioksīda.
Veidi, kā noteikt šķīdību
Tā kā šķīdība ir īpašība, ko nosaka eksperimentālā veidā, materiālu šķīdība jau ir novērtēta visdažādākajos šķīdinātājos. Tādējādi mēs varam piekļūt izšķīdušās vielas šķīdībai noteiktā šķīdinātājā šādi:
a) Tabulas analīze
Bieži vien students var saskarties ar šķīdību, interpretējot tabulu. Skatiet šo piemēru:
Piemērs: (UEPG - pielāgots) Zemāk esošajā tabulā parādīta Li sāls šķīdība2CO3 100 gramos ūdens.

Tabulā ir norādītas Li masas vērtības gramos2CO3 ko var izšķīdināt 100 gramos ūdens, no 0 OC līdz 50 OÇ. Mēs varam redzēt, ka jo karstāks ir ūdens, jo mazāk Li2CO3 izšķīst. Tāpēc Li2CO3 tas ir eksotermisks izšķīdis (tas vairāk izšķīdīs, ja ūdens būs auksts).
b) Grafika analīze
Šķīdību var novērtēt, interpretējot grafiku. Lai to izdarītu, vienkārši nosakiet temperatūru, pagrieziet to uz līkni un pēc tam pagrieziet līkni uz y asi, kas ir izšķīdušās vielas masa gramos.
Piemērs: (UFTM - pielāgots) Grafikā parādīta AX sāls šķīdības līkne2.
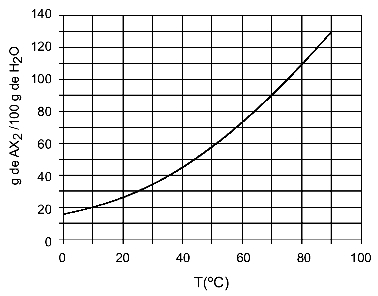
Grafikā teikts, ka uz y ass ūdens (šķīdinātāja) daudzums ir 100 grami. Par izšķīdušo AX2, mēs noteiksim ūdens daudzumu šādās temperatūrās:
30OÇ: Kad ieslēdzam temperatūru 30OC līdz līknei un pēc tam līknei uz y asi, mums ir tas, ka šajā temperatūrā 100 grami ūdens var izšķīdināt aptuveni 35 gramus izšķīdušās AX2.
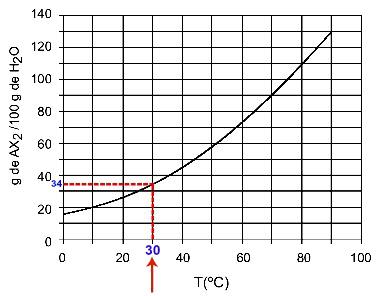
AX šķīdības noteikšana2 pulksten 30OÇ
40OÇ: Kad ieslēdzam temperatūru 40OC līdz līknei un pēc tam līknei uz y asi, mums ir tas, ka šajā temperatūrā 100 grami ūdens var izšķīdināt aptuveni 45 gramus izšķīdušās AX2.
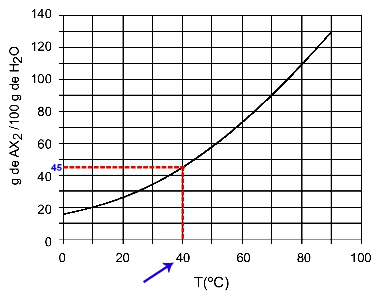
AX šķīdības noteikšana2 pie 40OÇ
Tā kā izšķīdušās izšķīdušās vielas daudzums ir lielāks ar katru temperatūras paaugstināšanos, mums ir tā AX2 tas ir endotermisks izšķīdis.
c) tekstuālā interpretācija
Skatiet šo piemēru:
Piemērs: (PUC-MG) Dažas vielas spēj veidot viendabīgus maisījumus ar citām vielām. Vielu, kuras daudzums ir vislielākais, sauc par šķīdinātāju, bet to, kuras daudzums ir vismazākais, - par izšķīdušo. Nātrija hlorīds (NaCl) ar ūdeni veido homogēnu šķīdumu, kurā 20 ° C temperatūrā ir iespējams izšķīdināt 36 g NaCl 100 g ūdens.
Tekstā norādīts, ka, ja mums ir 100 grami ūdens (šķīdinātājs), 20 ° C temperatūrā OC, ir iespējams izšķīdināt līdz 36 gramiem NaCl.
Autors: Diogo Lopes Dias
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-solubilidade.htm
