Viens pievienošanas reakcija ir ķīmisks process, kurā neorganiskas vielas atomus pievieno organiskai molekulai, kurai jābūt ar vienu no šīm īpašībām:
Atvērta struktūra, kas satur saistvielu vai pi saites;
Piesātināta slēgta struktūra (tikai ar sigmas saites);
Slēgta nepiesātināta struktūra (ar pi vai aromātisko saiti).
Organiskie savienojumi, kuriem piemīt šīs īpašības, ir šādi Ogļūdeņraži:
alkēni;
Alkīni;
Alkadiēni;
Ciklāni;
Velosipēdi;
Aromatika.
A laikā pievienošanas reakcija, viena vai vairākas pi obligācijas vai sigmas saite (tikai ciklāna gadījumā) ir sadalītas izraisot divu vai vairāku brīvu valenču parādīšanos (saistīšanās vietas) uz iesaistītajiem oglekļiem, kā piemērā zemāk:
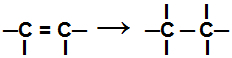
Pīra saites pārtraukšana alkēnā
Pēc šīs saites pārraušanas jaunajās saites vietās, kas izveidotas organiskajā savienojumā, jāpievieno atomi. Zemāk mēs uzskaitām pievienošanas reakcijas ko var veikt ar organiskiem savienojumiem.
hidrogenēšana
Šajā pievienošanas reakcijapapildus organiskajam savienojumam otrs reaģents ir gāzūdeņradis (H
2). Katrā no oglekļiem, kur notiek sadalīšanās (sigmas vai pi saites pārrāvums, kā redzams iepriekš), būs ūdeņraža atoma saite, kas attiecas uz šķelto saišu daudzumu.Piemēram, veicot ciklobutāna hidrogenēšanu, starp 1. un 2. ogli tiek pārtraukta sigmas saite. Tad ūdeņraža atoms saistās ar katru no šiem ogļiem:
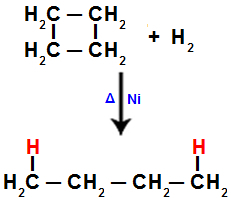
Vienādojums, kas attēlo hidrogenēšanu ciklobutānā
Halogenēšana
Papildus organiskajam savienojumam, otrs reaģents šajā pievienošanas reakcija ir molekulārais halogēns (hlora-Cl gāze2, fluora-F gāze2, cietais jods-I2 un šķidrais broms-Br2). Pie katra oglekļa, kur notiek sašķelšanās (sigmas vai pi saites pārrāvums, kā redzams iepriekš), būs savienojums ar halogēns atsaucoties uz bojāto savienojumu skaitu.
Tādējādi, veicot ciklopropēna halogenēšanu (izmantojot hlora gāzi), pi saite tiek pārtraukta starp 1. un 2. ogli. Tad hlora atoms saistās ar katru no šiem oglekļiem:

Vienādojums, kas apzīmē halogenēšanu ciklopropēnā
Pievienošanas reakcija ar halogenīdu
Halogenīds ir neorganiska hidroskābe, ko veido ūdeņraža atoms un ūdeņraža atoms. halogēns, piemēram, sālsskābe (HCl), fluorūdeņražskābe (HF), bromūdeņražskābe (HBr), skābe hidroiodiods (HI).
Plkst pievienošanas reakcija ar halogenīdu papildus organiskajam savienojumam otrs reaģents ir halogenīds, tātad viens no oglekĜiem, kur šķelšanai (sigmas vai pi saites pārrāvumam, kā redzams iepriekš) jāsaņem ūdeņraža atoms, bet otram - halogenīds.
Saskaņā ar Markovņikova valdīšana, visvairāk hidrogenētajam oglekļa atomam (vai mazākam radikalam piesaistītajam ogleklim) jāsaņem ūdeņradim, un mazāk hidrogenētajam ogleklim (vai ogleklim, kas pievienots lielākam radikalam) ir jāsaņem halogenīds.
Piemēram, kad mēs veicam šo reakciju ar propēnu ar sālsskābi (HCl), pi saite tiek sadalīta starp 1. un 2. ogli. Tad ūdeņradis saistās ar oglekli 1 (vairāk hidrogenēts) un hlors ar oglekli 2 (mazāk hidrogenēts):
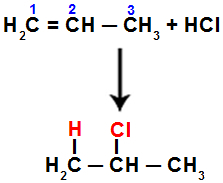
Vienādojums, kas apzīmē propēna pievienošanu ar halogenīdu
Hidratācijas reakcija
Ūdens molekula, jonizējot, rada hidronija katjonu (H+) un hidroksīda anjonu (OH-). Šī iemesla dēļ šajā pievienošanas reakcijapapildus organiskajam savienojumam otrs reaģents ir ūdens. Tādējādi viens no ogļiem, kur notiek sadalīšanās (sigmas vai pi saites pārrāvums, kā redzams iepriekš), saņem hidronija katjonu, bet otrs - hidroksīda anjonu.
Saskaņā ar Markovņikova likumu visvairāk hidrogenētais oglekļa atoms (vai ogleklis, kas pievienots mazākam radikalam) jāsaņem hidronijs, un mazāk hidrogenētajam ogleklim (vai ogleklim, kas pievienots lielākam radikalam) jāsaņem hidroksīds.
Piemēram, hidratējot penta-1,4 dienēnu, pi saite tiek pārtraukta starp 1. un 2. ogli un 4. un 5. ogli. Tad 1. un 5. ogleklis saņem hidroniju, bet 2. un 4. ogleklis saņem hidroksīdu:
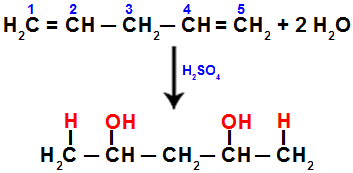
Vienādojums, kas attēlo pievienošanu ar hidratāciju penta-1,4 dienē
Autors: Diogo Lopes Dias
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-reacao-adicao.htm
