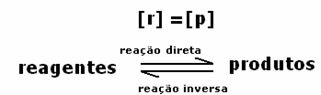
Reakcijas dinamiskais līdzsvars vai ķīmiskais līdzsvars rodas, ja vienlaicīga notiek uz priekšu un atpakaļ. Šīs tā saucamās atgriezeniskās sistēmas ir attēlotas ar bultiņām abos virzienos:  vai
vai  . Augšējā attēlā ir norādīts atgriezeniskas reakcijas piemērs starp joda gāzi un ūdeņraža gāzi.
. Augšējā attēlā ir norādīts atgriezeniskas reakcijas piemērs starp joda gāzi un ūdeņraža gāzi.
Reakcijas sākumā reaģentu daudzums ir maksimāls, bet produktu - nulle. Tomēr reaģenti reaģē viens ar otru, samazinot to koncentrāciju un palielinot izveidoto produktu koncentrāciju. Arī tiešās reakcijas attīstības ātrums samazinās.
Pieaugot produktu koncentrācijai, sākas apgrieztā reakcija, un reaģenti atkal tiek veidoti; palielinās arī apgrieztās reakcijas attīstības ātrums.
Sasniedzot ķīmisko līdzsvaru, nemainīgā temperatūrā uz priekšu un atpakaļgaitās reakcijas attīstības ātrums ir vienāds.
Visstieša = Visi apgriezts
Likmes ir vienādas, bet koncentrācijas nav. Reaģentu un produktu koncentrācija, visticamāk, nebūs vienāda. Tikai retos gadījumos tas notiek. Vairumā gadījumu reaģentu koncentrācija būs lielāka nekā produktu koncentrācija vai otrādi.
Tādējādi mums ir trīs iespējamie veidi, kā grafiski attēlot tiešās un apgrieztās reakcijas, kas saistītas ar reaģentu un produktu koncentrāciju virs laiks. Apskatīsim katru gadījumu:
1. gadījums: Vienādas koncentrācijas:
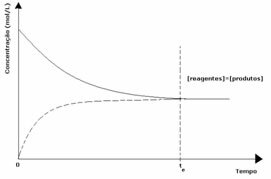
Kā redzams grafikā, brīdī tun reakcija uz priekšu un atpakaļ ir vienāda, šajā gadījumā reaģentu un produktu koncentrācija ir vienāda. Tādējādi līdzsvars netiek novirzīts uz abām pusēm, abu reakciju intensitāte ir vienāda, kā norādīts zemāk:
2. gadījums: Reaģentu koncentrācija, kas lielāka par produktu koncentrāciju:
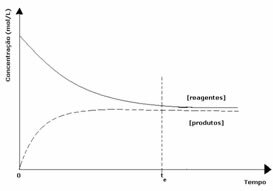
Šajā gadījumā tiek novērots, ka, sasniedzot līdzsvaru, reaģentu koncentrācija ir lielāka nekā produktu koncentrācija. Tādējādi tiek secināts, ka, ja reaģenta ir vairāk, apgrieztā reakcija notiek ar lielāku intensitāti. Reakcija tiek pārvietota pa kreisi:
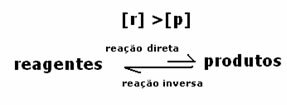
3. gadījums: Produktu koncentrācija, kas lielāka par reaģentiem:
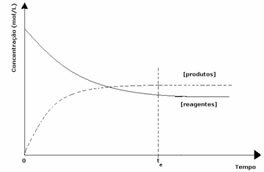
Tā kā līdzsvarā produktu koncentrācija ir lielāka, tas nozīmē, ka reakcija ir novirzīts pa labi, jo tiešā reakcija (ar produktu veidošanos) notiek ar lielāku intensitāte.
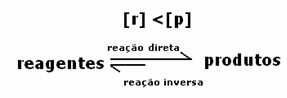
Tas, kas norādīs, vai reakcija ir vērsta uz labo vai kreiso pusi, būs līdzsvara konstante K, kas ir atkarīga tikai no temperatūras.
Autore Jennifer Fogaça
Beidzis ķīmiju
Brazīlijas skolu komanda
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/estudo-grafico-equilibrio-quimico.htm
