Ikdienā un laboratorijās notiek spontānas reakcijas un pārvērtības, bet citās - spontānas reakcijas. Piemēram, visa sadegšana ir spontāna reakcija, jo, tiklīdz tā sākta, tā turpināsies, līdz visa degviela būs iztērēta vai līdz viss skābeklis būs pazudis.
No otras puses, elektrolīze ir spontāns process, kurā elektriskā enerģija tiek pārveidota par ķīmisko enerģiju. Piemērs ir nātrija hlorīda (NaCl) elektrolīze. Kad elektriskā strāva tiek nodota pār šo izkausēto sāli, notiek redoksreakcijas un veidojas metālisks nātrijs (Nas)) un hlora gāzi (Cl2. punkta g) apakšpunkts). Ja mēs pārtrauksim darbināt elektrisko strāvu, reakcija turpināsies pati par sevi, kas parāda, ka tā nav spontāna.
Reakcijas spontanitāti var izmērīt, izmantojot Gibsa-Helmholca vienādojums, norādīts zemāk:

Uz ko:
∆G = brīvās enerģijas variācija;
∆H = entalpijas izmaiņas;
T = temperatūra Kelvinos (vienmēr pozitīva);
∆S = entropijas maiņa.
Šis vienādojums ir nosaukts, jo to ierosināja amerikāņu fiziķis Dž. Willard Gibbs (1839-1903) un vācu fiziķa Hermaņa Helmholca (1821-1894) autors.
Lai labāk saprastu, kā šis vienādojums palīdz mums noteikt reakcijas spontanitāti, īsumā pārskatīsim visus tajā iesaistītos jēdzienus:
- ∆H (entalpijas variācijas): Entalpija (H) ir vielas enerģijas saturs. Pagaidām nav zināms veids, kā to noteikt. Praksē tiek panākts procesa entalpijas variāciju (∆H) mērīšana, izmantojot kalorimetrus. Šī variācija ir enerģija, kas tika atbrīvota vai absorbēta procesā.
- ∆S (entropijas variācija):Entropija (S) ir termodinamiskais lielums, kas mēra traucējumu pakāpi sistēmā.
Piemēram, ledus kušanas laikā molekulas pāriet no cietas uz šķidru stāvokli, kur ir lielāka dezorganizācija. Tas nozīmē, ka šajā procesā entropija palielinājās (∆S> 0).
Amonjaka (NH3), 1 mol slāpekļa gāzes reaģē ar 3 mol ūdeņraža gāzes (tas ir, 4 mol molekulu reaģentos), radot 2 mol amonjaka:
N2. punkta g) apakšpunkts +3 H2. punkta g) apakšpunkts → 2 NH3. punkta g) apakšpunkts
Tā kā šajā procesā molekulu skaits gāzes fāzē samazinās, samazinājās dezorganizācija, kas nozīmē, ka samazinājās arī entropija (∆S <0).
- ∆G (Brīvā enerģija): Brīvā enerģija vai Gibsa brīva enerģija (jo to ierosināja tikai šis zinātnieks 1878. gadā) ir sistēmas lietderīgā enerģija, kas tiek izmantota darba veikšanai.
Sistēmai ir globāla enerģija, bet tikai daļa no šīs enerģijas tiks izmantota darba veikšanai, to sauc par Gibsa brīvo enerģiju, ko simbolizē G.
Pēc Gibsa teiktā process tiek uzskatīts par spontānu, ja tas veic darbu, tas ir, ja G samazinās. Šajā gadījumā transformācijas galīgais stāvoklis būs stabilāks nekā sākotnējais, kad ∆G <0.
Pamatojoties uz to, mēs varam secināt šādi:

Mēs varam arī redzēt, vai process būs spontāns, apskatot ∆H un ∆S algebrisko zīmi Gibsa-Helmholca vienādojumā:
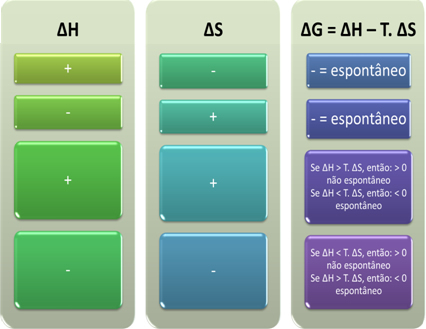
Autore Jennifer Fogaça
Beidzis ķīmiju
Avots: Brazīlijas skola - https://brasilescola.uol.com.br/quimica/energia-livre-gibbs.htm

